
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Практическое применение методов
|
|
|
|
Методы кислотно-основного титрования применяют в контроле производства в химической, текстильной, пищевой промышленности, в технологии пластмасс и волокон, удобрений, в металлургии и т.д.
Методами кислотно-основного титрования определяют концентрацию сильных и слабых кислот, сильных и слабых оснований, в том числе кислых и основных солей. Возможно также определение веществ, не обладающих кислотно-основными свойствами, но вступающих в реакцию с кислотами или основаниями. Содержание этих веществ обычно определяется методами прямого титрования, хотя в некоторых случаях используются методики обратного титрования и титрования по замещению.
Определение жесткости воды. Жесткость воды характеризуют молярной концентрацией эквивалентов кальция и магния (f э=1/2) и выражают в ммоль/л. Различают карбонатную, или устранимую, жесткость и постоянную. Карбонатная жесткость определяется содержанием в воде гидрокарбонатов. При кипячении они разлагаются
Ca(HCO3)2 → CaCO3 + H2O + CO2,
Mg(HCO3)2 → MgCO3 + H2O + CO2.
И жесткость воды устраняется или уменьшается. При кипячении вместе с карбонатами происходит соосаждение и некоторых других солей, поэтому устранимая жесткость несколько превышает карбонатную.
Постоянная жесткость вызывается наличием в воде других солей, кроме гидрокарбонатов, и при кипячении не уменьшается. Сумма карбонатной и постоянной жесткости воды составляет общую жесткость. Карбонатную жесткость определяют титрованием воды соляной кислотой в присутствии метилового оранжевого
HCO3– + H+ → H2O + CO2.
Если на объем воды V (H2O) мл затрачено V (HCl) мл соляной кислоты нормальной концентрации C (HCl), то карбонатная жесткость воды равна C (HCl)× V (HCl)×1000 / V (H2O).
|
|
|
Постоянную жесткость определяют методом обратного титрования. К отмеренному объему воды добавляют титрованный раствор Na2CO3 и выпаривают досуха. Карбонаты кальция и магния при этом выпадают в осадок. Сухой остаток растворяют в воде, не содержащей CO2, и в полученном растворе определяют количество Na2CO3, не вошедшего в реакцию осаждения карбонатов. Если к объему воды V (H2O) мл добавили V (Na2CO3) мл Na2CO3 нормальной концентрации C (1/2 Na2CO3) и на титрование избытка Na2CO3 израсходовали V (HCl) мл соляной кислоты нормальной концентрации C (HCl), то постоянная жесткость воды равна
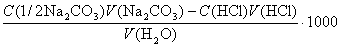 .
.
Этим методом определяют именно постоянную жесткость воды, а не общую, так как на осаждение карбонатов кальция и магния, присутствующих в воде в виде гидрокарбонатов, Na2CO3 не расходуется. Для определения жесткости воды в последнее время успешно применяют также комплексонометрические методы.
Определение солей аммония и азота в органических соединениях по Кьельдалю. Ион аммония NH4+ – очень слабая кислота, поэтому прямое титрование его в растворе с кислотно-основным индикатором невозможно. Определяют соли аммония обычно методом обратного титрования и титрования по замещению.
В одном из методов обратного титрования к анализируемому раствору добавляют избыток точно отмеренного стандартного раствора NaOH и нагревают до полного удаления NH3 из раствора, после чего оставшееся количество щелочи определяют титриметрически с метиловым оранжевым. Фенолфталеин в качестве индикатора не рекомендуется, так как возможно искажение результата за счет взаимодействия щелочи с CO2. Массу аммиака рассчитывают по формуле

В другом варианте метода обратного титрования к анализируемому раствору соли аммония добавляют избыток щелочи, и выделившийся аммиак отгоняют в определенный заведомо избыточный объем титрованного раствора кислоты. Количество кислоты, оставшейся в растворе после взаимодействия с аммиаком, определяют титрованием щелочью по метиловому оранжевому. Применение фенолфталеина и других индикаторов с pT>7 недопустимо, так как в реакцию могут вступить ионы аммония, присутствующие в растворе. Результат анализа рассчитывают по формуле обратного титрования
|
|
|
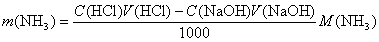
Отгонка аммиака используется в широко известном методе определения азота в органических соединениях по Кьельдалю. В простейшем варианте этого метода пробу обрабатывают при нагревании концентрированной серной кислотой в присутствии солей ртути (катализатор), в результате чего органические соединения окисляются до CO2 и H2O, а азот переходит в NH4HSO4. После охлаждения к остатку добавляют раствор щелочи и отгоняют NH3 в отмеренный объем титрованного раствора кислоты, а затем определяют избыток кислоты, не вошедшей в реакцию с аммиаком, и рассчитывают массу азота в пробе по формуле обратного титрования. Методом Кьельдаля можно определять азот в аминах, аминокислотах, алкалоидах и многих других азотсодержащих соединениях. Некоторые соединения можно проанализировать методом Кьельдаля только после предварительного разложения или восстановления хлоридом олова (II) или цинковой пылью (азосоединения, производные гидразина и т.д.).
Поглощать выделяющийся аммиак можно раствором борной кислоты. Образующийся борат-ион легко титруется соляной кислотой (по метиловому оранжевому) в присутствии избытка борной. Этот прием можно рассматривать как титрование по замещению.
Еще одним методом определения ионов NH4+ является формальдегидный метод, основанный на реакции иона аммония с формальдегидом
NH4+ + 6 CH2O → (CH2)6N4 + 4 H+ + 6 H2O.
Количество образующейся кислоты, согласно уравнению реакцииВ реакции образуется также уротропин (CH2)6N4., эквивалентно количеству солей аммония. В анализируемый нейтральный раствор вводят формальдегид, и выделившуюся кислоту титруют щелочью по фенолфталеину, так как реакция ионов аммония с формальдегидом обратима, но в слабощелочном растворе идет до конца. На практике часто приходится заранее определять поправку на муравьиную кислоту HCOOH, присутствующую в формальдегиде. Результат анализа рассчитывают по формуле
|
|
|
 .
.
Определение фосфора. Согласно данным, приведенным в разделе 2.7.2, фосфорная кислота может быть оттитрована как одно- или как двухосновная. При добавлении CaCl2 в раствор фосфорной кислоты образуется трехзамещенный малорастворимый фосфат кальция, и выделяется эквивалентное количество ионов водорода, благодаря чему фосфорная кислота титруется как трехосновная. Пирофосфорная кислота H4P2O7 титруется как двухосновная.
Для определения фосфора в рудах, концентратах и продуктах различной технологической переработки часто используют молибдофосфатный метод с титриметрическим окончанием. В азотнокислой среде фосфор осаждается молибдатом аммония в виде желтого осадка молибдофосфата аммония (NH4)3[PMo12O40], который после фильтрования и промывания растворяется в избытке титрованного раствора NaOH
(NH4)3[PMo12O40] + 27 OH– → 12 MoO42– + PO43– + 3 NH3 +15 H2O.
Избыток щелочи оттитровывается кислотой в присутствии фенолфталеина. В реакции титрования, кроме избытка NaOH, принимают участие ионы PO43– и молекулы NH3, что вызывает дополнительный расход кислоты в количестве 4H+ на каждый атом фосфора. Молярная масса эквивалента фосфора в этом методе будет составлять поэтому M(1/23P). Малая величина эквивалентной массы в значительной степени компенсирует многие методические недостатки этого способа, связанные с неполнотой оттитровывания аммиака в точке конца титрования с фенолфталеином, улетучиванием аммиака при титровании, поглощением CO2 из воздуха и т.д.
Определение спиртов. Спирты и многие другие органические вещества могут быть определены методом кислотно-основного титрования по замещению. При анализе спирта ROH к пробе добавляют определенный объем раствора уксусного ангидрида (CH3CO)2O в пиридине или другом подходящем растворителе, в котором легко и быстро протекает реакция между спиртом и ангидридом
(CH3CO)2O + ROH → CH3COOR + CH3COOH.
После окончания этой реакции к раствору добавляют воду для перевода оставшегося ангидрида в кислоту
(CH3CO)2O + H2O → 2CH3COOH.
И титрованием щелочью определяют общее количество уксусной кислоты, образовавшейся в результате обеих реакций.
|
|
|
Вторую такую же порцию раствора уксусного ангидрида растворяют в воде и вновь определяют количество образовавшейся уксусной кислоты. При взаимодействии уксусного ангидрида со спиртом из одной молекулы ангидрида получается одна молекула уксусной кислоты, а при растворении ангидрида в воде – две молекулы кислоты. Разница в объемах щелочи, затраченной на титрование, дает возможность рассчитать массу спирта
 ,
,
где V 1 – объем щелочи, израсходованный на титрование кислоты, которая образовалась при растворении ангидрида в воде после реакции со спиртом; V 2 – объем щелочи, израсходованный на титрование кислоты, которая образовалась при растворении ангидрида в воде.
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 448; Нарушение авторских прав?; Мы поможем в написании вашей работы!