
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Конспект лекций по органической химии
|
|
|
|
Государственное управление в области защиты населения и территорий от чрезвычайных ситуаций
Вопросы для самопроверки
1. Требования федерального законодательства и подзаконных актов в области защиты населения и территорий от ЧС природного и техногенного характера
2. Полномочия органов государственной власти и местного самоуправления Российской Федерации в области защиты населения и территорий от чрезвычайных ситуаций
4. Права и обязанности граждан РФ в области защиты населения и территорий от чрезвычайных ситуаций и социальная защита пострадавших
5. Права, обязанности и ответственность в области пожарной безопасности
Рекомендуемая литература:
1. Писаренко А.П., Хавин З.Я. «Курс органической химии», Москва, изд-во Высшая школа, 1985 г.
2. Швехгеймер М-Г.А. Кобраков К.И. «Органическая химия», Москва, Высшая школа, 1994 г.
ОСНОВЫ СТРОЕНИЯ УГЛЕВОДОРОДОВ.
Основой органической химии является теория химического строения, предложенная Александром Михайловичем Бутлеровым в 1861 году.
Основные положения:
1. Молекула любого вещества имеет единственно возможную последовательность расположения атомов, которую на плоскости изображается формулой строения (структурная формула).
Например, для брутто-формулы: C3H6O можно привести несколько структурных формул различных органических соединений:
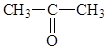



2. Любое изменение последовательности связей атомов приводит к изменению физико-химических свойств вещества, то есть к изомерии:
| Соединение | Т кипения, °С | Плотность, г/см3 |
 пропанон (ацетон)
пропанон (ацетон)
| 0,807 г/см3 | |
 пропаналь
пропаналь
| 0,790 | |
 пропилен оксид
пропилен оксид
| 0.859 | |
 пропен-2-ол-1
(аллиловый спирт)
пропен-2-ол-1
(аллиловый спирт)
| 0,854 |
3.Атомы в молекуле находятся в состоянии химического взаимодействия и оказывают взаимное влияние друг на друга независимо от того, находятся ли они по соседству (в контакте) или же разделены другими атомами.
|
|
|
Например, в молекуле уксусной кислоты 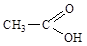 атом водорода в карбоксильной группе –СООН обладает кислыми свойствами, т.е. может отщепляться в воде в виде иона Н+, а атом водорода в группе –СН3 прочно связан с атомом углерода и не обладает кислыми свойствами. С другой стороны, увеличение длины углеводородного радикала может значительно уменьшить кислые свойства атома водорода в карбоксильной группе.
атом водорода в карбоксильной группе –СООН обладает кислыми свойствами, т.е. может отщепляться в воде в виде иона Н+, а атом водорода в группе –СН3 прочно связан с атомом углерода и не обладает кислыми свойствами. С другой стороны, увеличение длины углеводородного радикала может значительно уменьшить кислые свойства атома водорода в карбоксильной группе.
ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ.
Химическая связь подразделяется на электровалентную и ковалентную. Электровалентная связь образуется за счет передачи неспаренного электрона одного атома другому с образованием разноименно заряженных ионов, которые взаимно притягиваются: Na· + Cl → Na+ +:Cl-
Ковалентная связь возникает за счет обобщения неспаренных валентных электронов Н· + Н· → Н:Н
В органических соединениях, как правило, связь между атомами имеет ковалентный характер. Если ковалентная связь образуется между одинаковыми атомами, то такая связь является неполярной, то есть зона перекрывания электронных облаков располагается симметрично между атомами, ее образующими. Если же ковалентная связь образуется между атомами, резко отличающими электроотрицательностью (например, в галогенпроизводных углеводородах связь C−Hal), то говорят о полярности связи, о некотором смещении зоны перекрывания электронных облаков в сторону более электроотрицательного элемента.
В изолированном атоме углерода в его основном состоянии внешняя оболочка имеет строение 2s22px2py. При определенной затрате энергии один электрон с 2s-орбиты может быть поднят на 2pz, таким образом атом углерода способен проявлять валентность 4.
|
|
|
В валентных состояниях углерода электроны оказываются распределёнными не на чистых s и p-орбитах, а на гибридных. У атома углерода в молекуле метана четыре чисто атомные орбиты 2s2px2py2pz заменяются четырьмя гибридизованными орбиталями одинакового вида и равной энергии. Эти орбиты имеют концентрацию электронного облака вдоль некоторых осей, направленных к вершинам правильного тетраэдра под углом 109˚28′ и цилиндрическую симметрию относительно этих осей. Энергия, нужная для перемещения электронов углеродного атома с чисто атомных орбит (основного состояния) на гибридные орбиты (96 Ккал) с избытком компенсируются энергией образования более прочных связей (98,8·4= 395,2 Ккал). Таким образом, четыре простые ковалентные связи в метане образованы перекрыванием четырех гибридизованных орбит атома углерода (sp3-валентное состояние) с орбитами 1s атомов водорода.
Простая ковалентная связь, так называемая σ-связь, характеризуется достаточно высокой прочностью, что связывают с осевым перекрыванием образующих её электронных гибридизованных орбиталей.
Поляризация органических молекул в основном состоянии обуславливается взаимным влиянием атомов, которые принято называть электронными эффектами:
1. Индуктивный эффект проявляется при перераспределении электронной плотности σ-связи и приводит к её частичному смещению к более электроотрицательному атому. Обозначается прямой стрелкой.
---C+δ→Clδ-
Большинство атомов и групп, связанных с углеродом, оказывают такого рода влияние в том же направлении, вследствие большей электроотрицательности по сравнению с атомом углерода, они смещают электронную плотность от него (-I эффект), исключение составляют алкильные группы, являющиеся донорами электронов:
---С-δ ←СН3δ+
Индуктивный эффект – довольно слабый и значительно угасает при передаче по цепи углеродных атомов.
Отрицательным индуктивным эффектом (−I −эффект) обладают группы:
–F, –Cl, –Br, –OH, –NH2, –NO2;
Положительным индуктивным эффектом (+I−эффект) обладают группы: атомы щелочных металлов, алифатические радикалы (–СН3, –С2H5 и др.)
2. Мезомерный эффект проявляется при перераспределении электронной плотности в ненасыщенных и особенно в сопряжённых системах с участием π-орбиталей (эффект передается по кратным связям или с участием неподеленных пар электронов). Изображается изогнутой стрелкой: 
|
|
|
Мезомерные эффекты, в отличие от индуктивных, могут передаваться от одного конца сравнительно больших молекул к другому при наличии сопряжения.
+M-эффект характерен для групп: –F, –Cl, –Br, –I, –OH, –NH2;
-M-эффект проявляется в группировках: 
Индуктивный и мезомерный эффекты влияют на скорости органических реакций, на силу кислот и оснований, на реакционную способность соединений.
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАГЕНТОВ
Реагенты – атакующие частицы в органических реакция подразделяются на несколько типов:
1. радикалы – частицы, образующиеся в результате гомолитического разрыва ковалентной связи. 
2. электрофилы – катионы, образующиеся в результате гетеролитического разрыва ковалентной связи:

или частицы имеющие электронодефицитный атом.
Электрофилы: Н+,Н3О+,HNO3, H2SO4,BF3,AlCl3,ZnCl2,FeCl3.
3. нуклеофилы – анионы(продукты гетеролитического разрыва ковалентной связи) или частицы, имеющие атом с неподелённой парой электронов. например: 
Нуклеофилы: H-,H2N-,HO-,RO-,Hal-,=O:,=N:
Электрофилы и нуклеофилы в органических реакциях можно рассматривать как акцепторы или доноры, соответственно, электронных пар, принимающие их от одних или отдающие их другим атомам; такими атомами чаще всего являются атомы углерода.
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ.
Реакции в органической химии классифицируют по характеру превращения и по природе инициирующей частицы.
1. реакции замещения (S -substitution)
SR – замещение радикальное,
SN – замещение нуклеофильное,
SE – замещение электрофильное;
2. реакции присоединения (A- addition)
АR, AN, AE;
3. реакции отщепления (E- elimination)
ЕR,EN, EE;
4. реакции полимеризации,
5. реакции окисления, условное обозначение [O].
ОБОБЩЕННАЯ ТЕОРИЯ КИСЛОТ И ОСНОВАНИЙ.
Обобщенная концепция кислот и оснований была предложена Льюисом, который определял кислоты как молекулы или ионы, способные образовывать связь с неподеленной парой электронов, а основания – как молекулы или ионы, имеющие электронные пары, пригодные для образования такой связи.
|
|
|
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 713; Нарушение авторских прав?; Мы поможем в написании вашей работы!