
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сопряженные системы, виды сопряжения
 |
Спирты
Монофункциональные соединения
Это производные УВ, у которых один или несколько атомов Н замещены на –ОН группу.
Классификация:
I. По количеству групп ОН различают одноатомные, двухатомные и многоатомные спирты:
СН3-СН2-ОН 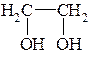
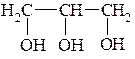
Этанол Этиленгликоль Глицерин
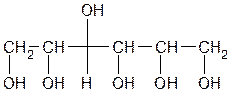
Сорбит
II. По характеру R различают: 1) предельные, 2) непредельные,
3) циклические, 4) ароматические.
2) СН2 = СН-СН2-ОН
Аллиловый спирт
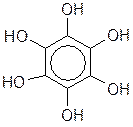 3) К непредельным циклическим спиртам относятся:
3) К непредельным циклическим спиртам относятся:
ретинол (витамин А) и холестерин

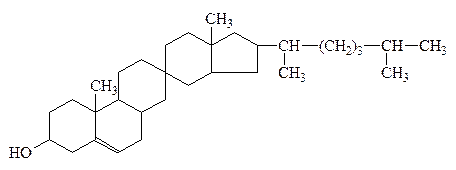 Инозит
Инозит
витаминоподобное в-во
группы В
|
| 4) | 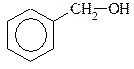 Бензиловый спирт
Бензиловый спирт
|
III. По положению гр. –ОН различают первичные, вторичные и третичные спирты.
IV. По количеству атомов С различают низкомолекулярные и высокомолекулярные.
СН3–(СН2)14 –СН2–ОН (С16Н33ОН) СН3–(СН2)29 –СН2ОН (С31Н63ОН)
Цетиловый спирт Мирициловый спирт
Цетилпальмитат – основа спермацета, мирицилпальмитат содержится в пчелином воске.
Номенклатура:
Тривиальная, рациональная, МН (корень+окончание «ол»+арабская цифра).
Изомерия:
цепи, положения гр. –ОН, оптическая.
Строение молекулы спирта


 СН-кислотный Nu центр
СН-кислотный Nu центр
|
|
Сопряженными системами называются соединения, в которых есть чередование двойных и ординарных связей. Простейшим примером такой системы является молекула бутадиена-1,3. Из структурной формулы видно, что в молекуле содержатся одна ординарная и две двойные связи углерод-углерод, которые должны иметь длины связей, соответственно, 0,153 нм и 0,132 нм, что характерно для длин ординарной и двойной связей углерод-углерод в алканах и алкенах. Физическими методами исследований было установлено, что длины связей между атомами С1 и С2, а также между С3 и С4 равны 0,135 нм, а длина связи между атомами С2 и С3 равна 0, 146 нм, молекула плоская, углы между связями равны 120°. Эти особенности объясняются возникновением сопряженной системы. Атомные орбитали всех атомов углерода в молекуле бутадиена-1,3 находятся в состоянии sp2-гибридизации, в результате которой каждый из них имеет три гибридные орбитали, лежащие в одной плоскости под углом 120° и одну негибридную р-орбиталь, располагающуюся перпендикулярно этой плоскости.
|
|
|

Пространственное строение бутадиена-1,3
Так как молекула имеет плоскую конфигурацию, то все s-связи, образованные с участием гибридных орбиталей, лежат в одной плоскости, а негибридные р-орбитали расположены перпендикулярно плоскости молекулы и параллельно между собой. Образование p-связей между атомами С1 и С2 и между атомами С3 и С4 происходит за счет двукратного перекрывания р-орбиталей с обеих сторон относительно плоскости молекулы, но так как все р-орбитали параллельны, то в молекуле имеет место дополнительное взаимодействие – перекрывание р-орбиталей между атомами С2 и С3, сопровождающееся выделением энергии, которая называется энергией сопряжения. В результате этого дополнительного перекрывания происходит перераспределение p-электронной плотности в молекуле и возникает делокализованная (сопряженная) p-система. При этом между атомами С1 и С2, а также С3 и С4 p-электронная плотность уменьшается, что приводит к увеличению длины этих связей в сравнении с длиной двойной связи С=С в алкенах, а между атомами С2 и С3 – p-электронная плотность увеличивается, что приводит к уменьшению длины связи в сравнении с длинами ординарных связей С-С в алканах.

Делокализация p-электронной плотности в бутадиене-1,3
В реальной молекуле бутадиена-1,3 нет двойных или ординарных связей, все четыре р-электрона делокализованы по всей системе сопряжения, охватывающей углеродный скелет.
|
|
|
Таким образом, под термином сопряжение понимают делокализацию (перераспределение) p-электронной плотности в молекуле, приводящую к изменению длин связей и увеличению ее устойчивости за счет выделения энергии. Различают два типа сопряжения: p,p- и p,p-сопряжение, которые могут возникать как в циклических, так и ациклических молекулах.
p,p-Сопряжение возникает, если в сопряжении участвуют р-орбитали, образующие p-связи. В рассмотренной выше молекуле бутадиена-1,3 в сопряжении участвовали четыре электрона атомов углерода, расположенные на р-орбиталях, образующих p-связи, таким образом, можно сделать вывод о том, что в этом случае имеет место p,p-сопряжение.

Примеры систем, имеющих p,p-сопряжение
В молекулах акролеина и винилацетилена сопряженная система возникает при участии четырех р-орбиталей, на которых находятся четыре электрона. В акролеине в p,p-сопряжении задействованы три р-орбитали атомов от трех атомов углерода, находящихся в sp2-гибридизации, и р-орбиталь атома кислорода. В винилацетилене в p,p-сопряжении участвуют две р-орбитали от двух атомов углерода, находящихся в sp2-гибридизации, и две р-орбитали от двух атомов углерода, находящихся в sp-гибридизации.
p,p-Сопряжение может быть и в циклических молекулах.

|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 2909; Нарушение авторских прав?; Мы поможем в написании вашей работы!