
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сопряженные реакции
Химической индукцией называется явление, характеризующееся тем, что химическая реакция (1), для которой химическое сродство A1>>0, инициирует протекание химической реакции (2), у которой химическое сродство отрицательно А2 < 0.
Две реакции, одна из которых индуцирует протекание другой, называются сопряженными.
Сопряженную реакцию можно представить в виде схемы:
A + B ® M;
A + C ® N;
A + B + C ® M + N.
Вещество A, в отсутствии вещества B, не реагирует с веществом С. Вещество А – называется актором, вещество В, реагирующее с актором и вызывающее, индуцирующее реакцию А и С, называется индуктором. Вещество С, взаимодействие которого с веществом А возможно только посредством химической индукции, называется акцептором.
Сопряженные реакции осуществляются в том случае, если промежуточные вещества первой стадии служат исходными для последующей стадии, вступая во взаимодействие с акцептором.
Примером сопряженной реакции может служить реакция между бромноватой кислотой и смесью сернистой и мышьяковистой кислот. Кислота 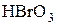 непосредственно окисляет сернистую кислоту
непосредственно окисляет сернистую кислоту  , но не окисляет
, но не окисляет  . Если подействовать бромноватой кислотой на смесь сернистой и мышьяковистой кислот, то окисляться будут и та и другая кислота.
. Если подействовать бромноватой кислотой на смесь сернистой и мышьяковистой кислот, то окисляться будут и та и другая кислота.
Рассмотрим подробнее, что происходит в системе при действии бромноватой кислоты на смесь сернистой и мышьяковистой кислот.
Рассчитаем стандартное сродство реакции
1. 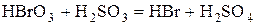 ,
,
считая её суммарной в гипотетическом гальваническом элементе, в котором на электродах протекают следующие полуреакции:
BrO3- +3H2O + 6 e = Br- +6OH- 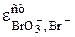 = 0,619 B
= 0,619 B
SO32- + 2OH- =SO42- +H2O + 2 e 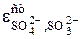 = - 0,93 B
= - 0,93 B
 = 6×96500(0,619 +0,93) = 891,7 кДж/моль
= 6×96500(0,619 +0,93) = 891,7 кДж/моль
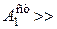 0.
0.
Рассчитаем аналогично стандартное сродство реакции
2. 
BrO3- +3H2O + 6 e = Br- +6OH- 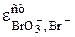 = 0,619 B
= 0,619 B
HAsO2 + 2H2O =H3AsO4 +2H+ + 2 e  = 0,56 B
= 0,56 B
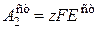 = 6×96500(0,619 - 0,56) = 34,2 кДж/моль
= 6×96500(0,619 - 0,56) = 34,2 кДж/моль
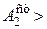 0, но при этом довольно мало. Очевидно поэтому реакция окисления мышьяковистой кислоты практически не идет.
0, но при этом довольно мало. Очевидно поэтому реакция окисления мышьяковистой кислоты практически не идет.
Почему же в присутствии всех трех кислот (HBrO3, H2SO3, H3AsO4) становятся возможны обе реакции: (1) и (2)?
Для ответа на этот вопрос нужно рассмотреть процесс окисления сернистой кислоты по стадиям:
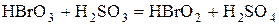
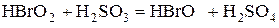


Образующиеся в результате сложной химической реакции промежуточные вещества 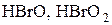 обладают настолько высокой реакционной способностью, что могут окислять мышьяковистую кислоту до мышьяковой.
обладают настолько высокой реакционной способностью, что могут окислять мышьяковистую кислоту до мышьяковой.
Покажем это, рассчитав стандартное сродство реакции с участием одного из промежуточных веществ HBrO:
3. 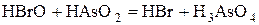
HBrO + H+ + 2 e = Br- +H2O  = 1,33 B
= 1,33 B
HAsO2 + 2H2O =H3AsO4 +2H+ + 2 e  = 0,56 B
= 0,56 B
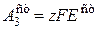 = 2×96500(1,33 - 0,56) = 148,6 кДж/моль
= 2×96500(1,33 - 0,56) = 148,6 кДж/моль
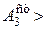
 и этого сродства оказывается достаточно для протекания реакции окисления мышьяковистой кислоты.
и этого сродства оказывается достаточно для протекания реакции окисления мышьяковистой кислоты.
Определения актора, индуктора и акцептора можно дать по-другому:
Актор - молекула или вещества, которое участвует в обеих сопряженных реакциях;
Индуктор - вещество, которое взаимодействует с актором и раскрывает его исключительную реакционную способность;
Акцептор - вещество, которое взаимодействует с активным промежуточным веществом и превращается в конечный продукт.
Сопряженные реакции являются примером, иллюстрирующим принцип действия неравенства Де Донде. Его можно записать либо черед скорость возникновения некомпенсированной теплоты, либо через скорость возникновения энтропии
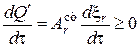
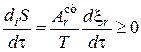
Если в системе протекают несколько химических реакций, связанных одним или несколькими общими реагентами, то полное производство энтропии

И для того, чтобы выполнялось это неравенство, совсем не обязательно, чтобы каждое слагаемое имело положительный знак. Уменьшение энтропии в результате одной реакции компенсируется увеличением энтропии в результате другой.
Например, при двух реакциях полное производство энтропии равно:
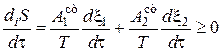 .
.
Причем, возможно, что  >> 0, а
>> 0, а 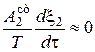 или < 0.
или < 0.
Это часто наблюдается в сопряженных реакциях в биологических системах.
|
|
Дата добавления: 2014-01-11; Просмотров: 1355; Нарушение авторских прав?; Мы поможем в написании вашей работы!