
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Материальный и Энергетический Баланс
При проектировании новых производств для анализа работы существующих с целью определения оптимальных значений параметров процесса составляют материальные и энергетические балансы производств.
Материальный Баланс – это вещественное выражение закона сохранения массы вещества, согласно которому во всякой замкнутой системе масса вещества, вступившая во взаимодействие равно массе веществ, образующихся в результате этого взаимодействия, т.е. приход вещества åGприход равен его расходу åGрасход. Таким образом, уравнение материального баланса можно представить в виде
åGприход = åGрасход
Для периодических процессов МБ составляют в расчете на одну операцию, для непрерывных процессов за единицу времени для установившегося режима. МБ может быть составлен для всех веществ участвующих в процессе или для одного кого-либо вещества (обычно для основного сырья).
МБ составляют для процесса в целом или для отдельных стадий. Определение массы веществ производится отдельно для твердой, жидкой, газообразной фаз.
Gт+Gг+Gж= G¢т+G¢г+G¢ж
Gт,Gг,Gж – массы твердых, газообразных и жидких веществ, поступающих в производство или на данную операцию в ед. времени.
G¢т,G¢г,G¢ж – массы веществ получаемых продуктов производств.
В производственных процессах между компонентом сырья кроме основной реакции, протекают побочные реакции. Кроме того, они возникают за счет примесей. Обычно при составлении МБ не учитывают все реакции, а лишь основные реакции, поэтому
åGприход = åGрасход+D,
где D - дебаланс (D - дельта)
Энергетический Баланс – составляют на основе закона сохранения энергии, в соответствии с которым в замкнутой системе сумма всех видов энергии постоянна. Или можно сказать так: в основу ЭБ положен закон сохранения энергии, согласно которому количество энергии, введенное в процесс, равно количеству выделяющейся энергии, т.е. приход энергии равно ее расходу.
Химико-технологические процессы связаны с затратой различных видов энергии – тепловой, механической, электрической. Поскольку в этих процессах тепловая энергия имеет наибольшее значение, то для химико-технологических процессов составляют тепловой баланс
åQприход = åQрасход
В этом случае закон сохранения энергии формулируется так: приход тепла в данной производственной операции åQприход равен расходу тепла в той же операции åQрасход.
Тепловой баланс – составляют по данным МБ с учетом тепловых эффектов химических реакций и физических превращений, протекающих в аппарате, а также с учетом подвода тепла извне и отвода ее с продуктами реакции, а также потери в окружающую среду через стенки аппарата.
В общем виде тепловой баланс выражают уравнением:
Qт+Qж+Qг+Qф+Qр+Qn= Qт¢+Qж¢+Qг¢+Qф¢+Qр¢+Qn¢
Qф¢,Qф – тепло, выделяемое и поглощаемое при физических процессах.
Qр¢, Qр – тепло, экзотермических и эндотермических реакций.
Qn – тепло, подводимое в аппарат извне.
Qn¢ – потери теплоты в окружающую среду
Qт , Qж , Qг – тепло, вносимое с поступающими в аппарат твердыми, жидкими и газообразными веществами.
Qт¢, Qж¢, Qг¢ – тепло, уносимое выходящими веществами.
(Экзо – реакция протекает с выделением энергии, эндо – реакция протекает с поглощением энергии).
Закон Г.И. Гесса (открыл в 1836) – основной закон термохимии. Термохимия – изучает тепловые эффекты химических реакций, а также теплоту образования и разбавления растворов.
Из закона Гесса: если из данных исходных веществ можно получить заданные конечные вещества различными путями, то суммарная теплота на одном каком-нибудь пути равна суммарной теплоте процесса на любом другом пути, т.е. тепловой эффект химической реакции зависит только от начального и конечного состояний системы, но не зависит от пути перехода.
Qр = – DН
DН=åDНпродукты – åDНисходных продуктов.
DН – тепловой эффект химической реакции.
Иногда Qт , Qж , Qг и Qт¢, Qж¢, Qг¢ называют теплосодержанием, каждый в отдельности определяется по формуле:
Q=C×T×G
C – теплоемкость [Дж/моль×К]
Для газообразных продуктов:
Ср=ao + a1T±a2T2
где ao, a1, a2 – табличные коэффициенты (справочник под редакцией Равделя и Понамаревой).
Теплоемкость газовой смеси определяют исходя из закона аддитивности. Аддитивность – это способность складываться целого из его частей
Ссложное целое=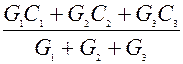
где G – масса вещества?
C – теплоемкость
Химическая, принципиальная технологическая схема химико-технологических процессов.
На первом этапе создания и строительства химико-технологического процесса (ХТП) разрабатывается химическая схема производства. Разработка химической схемы базируется на экспериментальных данных. В лабораторных условиях изучают все химические реакции, определяют механизм и кинетику основных побочных реакций, реакций превращения и утилизации отходов производства. В ходе научного поиска определяют пути осуществления химических реакций в промышленных условиях, решаются вопросы аппаратурного инженерного оформления. Критерием окончательного выбора химической системы является экономичность и экологическая безопасность производства.
Химическая схема: Производства эпихлоргидрина.
Основная 2СH2Cl – CH – CH2Cl+Ca(OH)2®2CH2 – CH-CH2Cl+CaCl2+H2O
реакция ОH гидроксид O хлорид
α и β - дихлоргидрин- кальция эпихлогидрин кальция
глицерин
Побочная реакция:
1) СН2 – СН – СН2Сl+H2O®CH2 – CH – CH2Cl α – моно-хлоргидрин
|
|
Дата добавления: 2014-01-11; Просмотров: 2285; Нарушение авторских прав?; Мы поможем в написании вашей работы!