
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесие в технологических процессах
Или
O OH OH глицерин
эпихлоргидрин
CH2 – CH – CH2Cl+H2O®CH2 – CH – CH2+HCl
O OH OH OH
Глицерин
HCl+Ca(OH)2®CaCl2+H2O
Принципиальная схема:
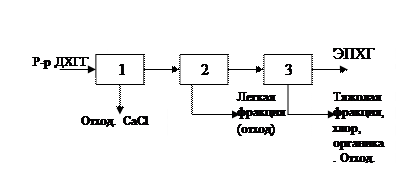
Принципиальная схема обычно используется в научно-технической и учебной литературе для графического изображения и для описания основных стадий процесса. Общее графическое представление о химико-технологических процессах дает принципиальная схема производства. Строгих правил для оформления принципиальной схемы не установлены, они показывают связь между основными физическими и химическими процессами и операциями, составляющими технологический процесс. Каждый процесс показывают условно в виде кружков или квадратов.
Для более полного и наглядного представления разрабатываются технологические схемы производства. Изображения технологической схемы отличается от изображения принципиальной схемы тем, что в технологической схеме указываются все аппараты (основные и вспомогательные), материальные потоки и тепловая связь между ними.
Аппараты в схеме вычерчивается по ГОСТ 2788-74 – «Обозначения графические условные». Параллельно работающие аппараты изображаются в виде одного аппарата, индексами указывается их общее число. При создании ХТП на стадии проектирования разрабатывается схема контроля и регулирования технологических параметров. Этим занимаются службы КИПиА (контрольно-измерительные приборы и аппараты) проектных институтов или специальное конструкторское бюро.
Технологическая схема включающая схему контроля и автоматизации называется полной технологической схемой.
Описание технологической схемы получения эпихлоргидрина. Процесс производства эпихлоргидрина состоит из двух частей:
1. Дегидрирование – отщепление водорода путем окисления или нагревания.
2. Ректификация – разделение смесей.
Раствор дихлоргидринглицерина (4-5%-ный) подогревается до 60-70°С в подогревателе [1] и поступает на верхнюю тарелку реактора [2], куда одновременно подается известковое молоко (раствор Са(ОН)2). В нижнюю часть реактора подается «острый» пар («острый» пар – когда кипит вода) в количестве, необходимом для проведения реакции и отгонки образующегося эпихлоргидрина в виде азеотропной смеси с водой. Кубовая жидкость, содержащая не прореагировавшую гидроокись кальция и образовавшийся глицерин, выводится из нижней части реактора и направляется на очистку. Образующийся эпихлоргидрин вместе с парами выводится сверху из реактора, конденсируется в конденсаторе [3], разделяется фазоразделителем [4]. Вода, содержащая до 6% эпихлоргидрина, возвращается после фазоразделителя на орошение верхней части реактора. Эпихлоргидрин (85-90%) из фазоразделителя [4] поступает в колонну [5], где производится азеотропная сушка эпихлоргидрина. Вода вместе с низкокипящими примесями, в основном хлористый аллил и 2,3-дихлорпропен, отделяется в виде дистиллята и выводится из системы как отходы. Осушенный эпихлоргидрин из куба колонны [5] поступает на питание колонны [6]. В колонне [6] отделяются высококипящие «тяжелые» примеси, состоящие из 1,2,3-трихлорпропана и b-дихлоргидринглицерина. Кубовая жидкость колонны [6] является питанием колонны [9]. В этой колонне в виде дистиллята отбирается товарный 1,2,3-трихлорпропан, а кубовая жидкость в основном содержащая b-хлоргидринглицерина, возвращается в реактор [2]. Дистиллят колонны [6] представляет собой предварительно очищенный (98-99%) эпихлоргидрин, который поступает в колонну [7]. Товарный эпихлогидрин концентрацией более 99,5% отбирается из паровой фазы 2-й тарелки, конденсируется в конденсаторе [8] и выводится из системы. Дистиллят колоны [7] содержащий «легкие» примеси и эпихлогидрин, возвращается на питание колонны [5], а кубовая жидкость колонны [7], содержащая «тяжелые» примеси и эпихлогидрин возвращается на питание колонны [6]. Схема с 2-хкратным отделением «легких» и «тяжелых» примесей гарантирует высокую степень чистоты товарного эпихлогидрина.
Эпихлогидрин является важным мономером для эпоксидных смол, синтетического глицерина, ионообменных смол, красок, лаков (около 90% эпоксидных смол получают из эпихлогидрина).
(Цех №16 ЗАО «Каустик», где получают и для чего, для получения глицерина)
Основные закономерности химической технологии.
Любой ХТП состоит из следующих взаимосвязанных процессов (стадий):
1. Подвод реагентов в зону реакций.
2. Химические реакции
3. Отвод продуктов реакции из зоны реакции.
Общая скорость технологического процесса может определяться скоростью одного из 3-х составляющих элементарных процессов, который протекает медленнее других. Эту стадию называют лимитирующей. Подвод реагентов в зону реакции и отвод продуктов из зоны реакции совершается молекулярной диффузией или конверсией и переходом вещества из одной фазы в другую. Если лимитирующей стадией является подвод или отвод реагентов из зоны реакции, то это значит, что процесс происходит в диффузионной области. В этом случае для интенсификации необходимо снять диффузионные ограничения (торможения). Например: турбулизация потока реагентов путем перемешивания, увеличение давления, температуры и концентрации. Если наиболее медленно идут химические реакции, и они лимитируют общую скорость, то говорят, что процесс происходит в кинетической области. Для интенсификации в этом случае повышают температуру и концентрацию реагентов, применяют катализаторы.
В классификации технологических процессов большое значение имеет необходимый для их оптимизации технологический режим.
Технологическим режимом – называется совокупность основных факторов (параметров), влияющих на скорость процесса, выход и качество продукта.
Классификация химических реакций.
В зависимости от фазового состава реакционной системы различают гомогенный и гетерогенные химические реакции.
В гомогенных процессах химические реакции протекают в одной фазе (газовой или твердой, или жидкой).
Газовая фаза (реакция окисления) N2+O2=2NO.
В случае гетерогенных реакций один или несколько реагентов находится в фазовом состоянии отличным от фазового состояния других реагентов реакции.
Различают двухфазные системы: Г-Ж, Г-Тв, Ж-Тв, Ж-Ж(несмешивающийся).
По механизму осуществления реакции делятся на: простые и сложные. Для описания простых реакций достаточно одного стехиометрического уравнения:
А®R или А+В®R.
К сложным относятся реакции, состоящие из 2-х или более взаимосвязанных между собой простых реакций. Они бывают:
1) параллельные:
A®R
или
A®S 
2) последовательные: А®R®N.
Для описания сложных реакций необходимо несколько стехиометрических уравнений. В действительности все химические реакции обратимы (A→R). Однако, некоторые реакции в одном из направлений протекают с очень малой скоростью, поэтому реакции считают необратимыми.
Например:
BaCl2 + Na2CO3 ® BaCO3¯+ + 2NaCl.
хлорид карбонат карбонат хлорид
бария натрия бария натрия
С точки зрения кинетики реакции классифицируются по молекулярности и по порядку реакции.
Молекулярность реакции характеризуется числом молекул, при одновременном взаимодействии которых происходит элементарный акт химического взаимодействия. По этому признаку химические реакции бывают: моно-, ди- и тримолекулярные. Порядок реакции определяется суммой показателей системы у концентрации в уравнении скорости реакции по закону действия масс
aA+bB®cC+dD±Q (тепловой эффект)
Скорость реакции:
u=k×CAa×CBb
k – const скорости, зависит от природы реагирующих веществ и от температуры.
С – концентрация вещества [моль/л].
с, d, a, b – стехиометрические коэффициенты
Порядок реакции:
n=a+b
По этому признаку реакции бывают 1-го, 2-го, 3-го и дробного порядка.
По тепловому эффекту реакции делятся на:
экзотермические (Q>0,, DH<0) – выделение теплоты в окружающую среду, эндотермические (Q<0, DH>0) – поглощение теплоты из окружающей среды.
Q – тепловой эффект химической реакции;
DH – энтальпия или теплосодержание.
Все химические реакции обратимы и в зависимости от условий они могут протекать как в прямом, так и в обратном направлении.
Все обратимые химико-технологические процессы стремятся к равновесию, при котором скорости прямого и обратного процессов уравниваются и система находится в равновесии.
В условиях равновесия реакции
aA + bB→ sS + rR
u1= k1×CAa×CBb
u2= k2×CSa×CDd , по условию равновесия
u1=u2 , тогда k1×CAa×CBb = k2×CSs ×CRr
где R1 и R2 − сonst скорости прямой и обратной реакции
k1/k2= CSs ×CRr / CAa×CBb= Kp .
где Kp − сonst равновесия.
Как следует из уравнения, константа равновесия зависит от концентрации, т.к. изменение концентрации одного из компонентов равновесной системы вызывает такие же изменение концентрации всех остальных веществ и значение Kp остается прежним. Сдвигая равновесия в сторону получения целевых продуктов можно повысить эффективность производства.
Основными параметрами, влияющими на равновесие химических реакций, является температура, давление и концентрация реагирующих веществ.
Константа равновесия и энергия Гиббса.
Определяя изменения изобарно- изотермического потенциала (энергия Гиббса) для реакций, которые протекают в рассматриваемом процессе, и сравнивая их, устанавливают термодинамически наиболее вероятную реакцию.
Изменение изобарно-изотермического потенциала (DG) определяют на основе экспериментальных данных. В общем случае изобарно-изотермический потенциал рассчитывается как
DG = SDGконечных продуктов - SDGисходных продуктов
Для реакции
аA + bB ®¬ cC + dD
DG = c×DGc + dDGD – aDGA − bDGB
Между изобарно-изотермическим потенциалом и константой равновесия существует взаимосвязь:
DG = − RTlnК.
Если отсутствуют табличные значения, то изобарно-изотермический потенциал рассчитываем по уравнению:
DG = DH – T×DS,
где DH- тепловой эффект реакции,
DS – изменение энтропии при реакции.
На основе экспериментальных данных обычно исходят из теплового эффекта реакции, найденного опытном путем. Значение DH и DS находят по справочным таблицам. Порядок и знак изобарно-изотермического потенциала (DG) позволяет расчетным путем определить положение равновесия.
DG £ 0, Kp ³ 1 – реакция протекает слева направо, в сторону продуктов.
DG ≥ 0, Kp £ 1– реакция протекает справа налево.
DG = 0, Kp = 1– равновесие
Решаем совместное уравнение:
− RT ∙ lnК = DH – T×DS
lnК = 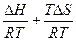
К = е е
Из этого уравнения следует, что для экзотермических реакций 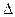 Н < 0 протекающих с изменением энтальпии
Н < 0 протекающих с изменением энтальпии 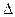 S > 0, К > 1,
S > 0, К > 1, 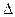 G < 0 (тепловой эффект реакции).
G < 0 (тепловой эффект реакции).
Для эндотермических реакций 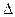 Н > 0, протекающих с уменьшением
Н > 0, протекающих с уменьшением 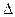 S < 0,
S < 0,
К < 1, 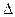 G > 0/
G > 0/
Сдвиг равновесия под влиянием концентрации реагирующих веществ.
Концентрация реагирующих веществ оказывает сильное влияние на выход целевых продуктов. Возьмем реакцию в общей форме:
А + В → R + S
K = CR ∙ CS/CA ∙ CB величина постоянная при данной температуре.
Константа равновесия будет равна отношению концентрации конечных продуктов на концентрацию исходных веществ.
К – величина постоянная, при данной температуре.
Допустим, увеличили концентрацию исходных веществ CA и CB, возрастает знаменатель, чтобы const равновесия оставалась постоянной, нужно увеличить числитель, т.е. повышается концентрация продуктов реакции. И наоборот, при уменьшении концентрации продуктов реакции, соответственно уменьшается концентрация исходных реагентов, т.о. увеличивается степень их переработки.
Эти способы на практике используются для сдвига равновесия в сторону целевого продукта, т.е. для увеличения выхода.
Рассмотрим примеры практического осуществления этих приемов:


Схема 1. Процесс обычно осуществляется по циркуляционной (циклической системе). (1 – реактор, 2 – конденсатор)
Уменьшается концентрация продуктов реакции путем вывода веществ. Увеличивается концентрация исходных веществ за счет рециркуляции.
Смесь исходных веществ А и В поступает в реактор [1] в котором происходит химическое взаимодействие между реагентами. На выходе из реактора в газовой смеси содержится продукт реакции и не прореагировавшие исходные реагенты А и В. Газовая смесь поступает в конденсатор [2], где она охлаждается, при этом продукт реакции R конденсируется и выводится из системы, а исходные реагенты А и В возвращается в процесс.

Схема 2.
1, 2, 5 – реактор
3, 4 – конденсатор
Уменьшение концентраций продуктов реакции за счет вывода продукта R, а затем S.
Сдвиг равновесия под влиянием температуры.
В соответствии с принципом Ле Шателье, если на систему находящуюся в равновесии, воздействовать извне путем изменения какого-либо условия, определяющего положение равновесия, то в этой системе усиливается такой процесс, течении которого ослабляет влияние произведенного воздействия. При этом положение равновесия смещается в соответствующем направлении.
Для реакций, протекающих в газовой фазе по уравнению:
 2SO2 + O2 → 2SO3 +
2SO2 + O2 → 2SO3 + 
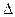 Н – реакция экзотермическая, так как выделяет тепло в окружающую среду.
Н – реакция экзотермическая, так как выделяет тепло в окружающую среду.
При равновесии справедлива следующая формула:
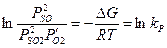
P – парциальное давление
R – газовая постоянная
T – абсолютная температура.
Если под внешним воздействием изменяется значение одного из членов равенства, то равновесие нарушается, так как равновесие характеризуется скоростью прямой и обратной реакции. Равновесие смещается в том случае, если произведенное воздействие не одинаково влияет на скорости прямой и обратной реакции. Это нарушение равенства скорости и приводит к переходу системы в новое состояние равновесия, при котором скорость прямой реакции равна скорости обратной реакции, но их значения будут отличаться от первоначальных значений.
Возьмем экзотермическую реакцию
SO2 + 1/2O2®¬ SO3 + DH
Согласно принципу Ле Шателье, чтобы увеличить выход SO3, т.е. сместить равновесие в сторону образования конечного продукта SO3 необходимо систему охладить, т.е. организовать отвод тепла, т.к. за счет выделяющегося тепла повышается температура реакционной смеси, и равновесие сдвигается влево и равновесная концентрация целевого продукта SO3 уменьшается.
Для эндотермической реакции:
CH4 + H2O ®¬ CO + 3H2 - DH.
метан
Чтобы равновесие сместилось в сторону прямой реакции необходимо организовать подвод тепла в систему.
График зависимости равновесной степени превращения от температуры.
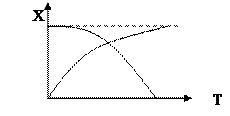 1 – экзотермическая реакция
1 – экзотермическая реакция
2 – эндотермическая реакция.
Сдвиг равновесия под влиянием давления.
Давление – является также важным фактором, с помощью которого в производственных условиях регулируют равновесием химических процессов, и следовательно, изменяют максимально возможную степень использования сырья. Качественное влияние изменения давления на равновесие химических реакций можно установить также на основе принципа Ле-Шателье. Рассмотрим 3 реакции, в которых общий объем газа в процессе реакции изменяется в различной степени:
В 1 реакции – объем газов уменьшается, во 2 реакции – увеличивается, в 3 реакции – остается без изменений.
N2 + 3H2 ®¬ 2NH3
OH4 ®¬ C + 2H2
CO + H2O ®¬ H2 + CO2.
1-я реакция протекает с уменьшением объема, т.к. из 4-х молекул газа
(1 молекула азота + 3 молекулы водорода) образуется 2 молекулы аммиака, следовательно, уменьшается давление, то по принципу Ле-Шателье, для смещения равновесия слева на право, необходимо повысить давление, что на практике и делают – процесс ведут под давлением 32 Мпа.
Для 2-й реакции, протекающей с увеличением объема, следовательно, и с увеличением давления нужно понижать давление.
Для 3-й реакции ничего не нужно делать, т.к объем системы, не изменяется, т.е. не зависит от давления.
|
|
Дата добавления: 2014-01-11; Просмотров: 693; Нарушение авторских прав?; Мы поможем в написании вашей работы!