
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние диссоциации воды на растворимость осадков
|
|
|
|
[ Д.Скуг, Д.Уэст. основы аналитической химии. Т.1. Под редакцией чл.-корр. АН СССР Ю.А.Золотова. Изд. Мир. М. 1979 с.110 – 116 ] (В лекцию и в коллоквиум не входит)
В предыдущем разделе показано, что если анион осадка M p A q является анионом слабой кислоты H m A, то в водном растворе равновесие растворимости осадка будет смещаться в сторону его растворения, вследствие протонирования аниона (связывания анионов в недиссоциированные формы кислоты).
Во многих случаях взаимодействием осадка с водой нельзя пренебречь, не допустив ошибки в расчетах его растворимости. Как следует из таблицы 3.4, для гипотетического осадка MA, величина ошибки зависит от значений произведения растворимости осадка и от константы диссоциации кислоты.
Таблица 3.4 – Растворимость гипотетических осадков MA с учетом и без учета протонирования за счет диссоциации воды
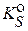 Произведение
Растворимсти
МА
Произведение
Растворимсти
МА
| K HA Константа диссоциации НА | Растворимость вычисленная
c учетом влияния
диссоциации воды, 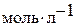
| Растворимость вычисленная
без учета влияния
диссоциации воды, 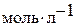
|
| 1.0·10–10 | 1.0·10–6 | 1.0·10–5 | 1.0·10–5 |
| –,,– | 1.0·10–8 | 1.2·10–5 | –,,– |
| –,,– | 1.0·10–10 | 2.4·10–5 | –,,– |
| –,,– | 1.0·10–12 | 10.0·10–5 | –,,– |
| 1.0·10–20 | 1.0·10–6 | 1.05·10–10 | 1.0·10–10 |
| –,,– | 1.0·10–8 | 3.3·10–10 | –,,– |
| –,,– | 1.0·10–10 | 32.0·10–10 | –,,– |
| –,,– | 1.0·10–12 | 290.0·10–10 | –,,– |
Растворимость осадка MA, представленная в третьей колонке, получена с учетом реакции аниона A– с водой. В четвертой колонке приведены результаты расчета без учета оснóвных свойств A–; растворимость в этом случае просто равна корню квадратному из произведения растворимости.
Видно, что пренебрежение взаимодействием аниона с водой приводит к отрицательной ошибке, которая тем больше, чем меньше растворимость осадка, то есть чем меньше значение 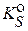 , и чем более сильным основанием является анион
, и чем более сильным основанием является анион
|
|
|
осадка (чем меньше значение K HA). Для упрощения очень громоздких алгебраических вычислений растворимости осадка, образованного анионом слабой кислоты, в воде обычно можно сделать одно из двух допущений.
Первое допущение применимо для осадков с умеренной растворимостью, когда растворимость без учета протолиза 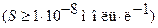 . В этом случае допускается, что концентрация образующихся гидроксид ионов достаточна, чтобы пренебречь вкладом гидроксид ‑ ионов за счет диссоциации воды. Методики
. В этом случае допускается, что концентрация образующихся гидроксид ионов достаточна, чтобы пренебречь вкладом гидроксид ‑ ионов за счет диссоциации воды. Методики
расчетов с учетом влияния диссоциации воды в этом случае достаточно
громоздки и мы рассматривать их не будем.
Допущения второго типа относятся к осадкам с очень низкой растворимостью ( . В этих случаях, несмотря на протолиз осадка, концентрация [ОН‑], образующаяся вследствие протолиза, оказывается намного меньше концентрации [ОН‑], образующейся при диссоциации воды, и среда остается практически нейтральной. Так как в чистой воде (при 25°С)
. В этих случаях, несмотря на протолиз осадка, концентрация [ОН‑], образующаяся вследствие протолиза, оказывается намного меньше концентрации [ОН‑], образующейся при диссоциации воды, и среда остается практически нейтральной. Так как в чистой воде (при 25°С)
[OH– ] = [H3O+] = = 10–7 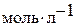 , то для расчета растворимости осадка, в зависимости от оснóвности кислоты, значения
, то для расчета растворимости осадка, в зависимости от оснóвности кислоты, значения 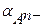 вычисляют по одному из уравнений (3.21) – (3.23) при [H3O+] = 10–7
вычисляют по одному из уравнений (3.21) – (3.23) при [H3O+] = 10–7 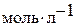 , а затем рассчитывают растворимость.
, а затем рассчитывают растворимость.
Пример: Рассчитать растворимость сульфида серебра в воде:
а) без учета протонирования (гидролиза)
б) с учетом протонирования (гидролиза).°
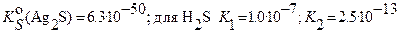
Основные равновесия:
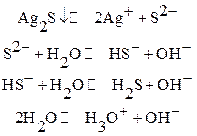
а) 
б) Так как S << 10–8  , то можно принять [H+] = 1·10–7
, то можно принять [H+] = 1·10–7  . Тогда
. Тогда
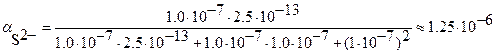
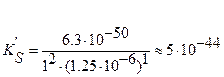 ;
; 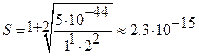
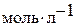
Таким образом, фактическая растворимость Ag2S в воде с учетом диссоциации воды в 100 раз выше, чем без этого учета.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 800; Нарушение авторских прав?; Мы поможем в написании вашей работы!