
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ТД потенциалы
|
|
|
|
Инфляционный разрыв
Рецессионный разрыв
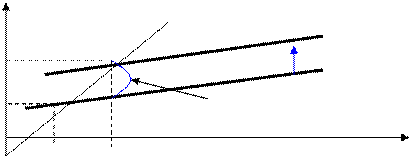 |
СуВ СуВ = ВВП
СуВ2 Т2 СуВ2
СуВ1
СуВ1 Т1 Рецесійний розрив
ВВП1 ВВПп ВВП
 |
СуВ СуВ = ВВП
СуВ1 Т1 СуВ1
СуВ2 Т2 Інфляційний розрив
ВВП2 ВВП1 ВВП
1 начало ТД: dQ = dU + p dV.
Здесь ВЭ U, давление p и объем V – функции состояния, а количество теплоты Q не является ею, т.к. зависит от процесса, в котором получено. Но дифференциал dQ можно выразить через функции состояния: dQ = T dS, характер процесса выражен через приращение dS.
dU = T dS - p dV - это способ выразить ВЭ через ТД параметры, энтропия к ним причислена (вообще, любую функцию состояния можно считать параметром).
Можно определить (ввести) новую функцию состояния – энтальпию (от греч. enthálpo — нагреваю):
H = U + p V => dH = T dS – p dV + p dV + V dp => dH = T dS + V dp
Если р = const (ИБП), DH = T DS = DQ – энтальпия равна количеству теплоты, подводимой к телу при постоянном давлении, поэтому другое ее название – теплосодержание.
Еще одно преобразование dU = T dS - p dV => определяется новая функция состояния свободная энергия Гельмгольца (СЭГе):
F = U – T S => dF = - p dV – S dT
Почему называется свободной энергией? Если T = const, то p dV = dА = - dF, т.е. работа совершается за счет уменьшения СЭ, СЭ это та часть ВЭ, которая может быть превращена в работу при T = const.
В отличие от нее оставшаяся часть ВЭ U – F = T S – называется связанной энергией.
Далее определяется еще одна функция состояния - свободная энергия Гиббса (СЭГи):
G = F + p V => dG = - S dT + V dp
Все вместе U, H, F и G называются термодинамическими потенциалами (ТДП), отдельно СЭГи часто называется ТДП Гиббса.
| ВЭ | U(S,V) | dU = T dS - p dV |
| Энтальпия | H(S,p) = U + p V | dH = T dS + V dp |
| СЭГе | F(T,V) = U – T S | dF = - p dV – S dT |
| СЭГи | G(T,p) = F + p | dG = - S dT + V dp |
Общие свойства ТДП: 1. Имеют размерность энергии
|
|
|
- Аддитивны
- Определены с точностью до постоянного слагаемого.

Набор изотерм реальных газов

Кривая АКВ, разделяющая жидкое и газообразное (пар) состояния
Про однофазное, двухфазное и критическое состояния
В двухфазном состоянии свойства жидкости и газа резко отличаются:
1) они разделены в пространстве, и между ними есть граница раздела;
2) для перехода из жидкости в пар требуется теплота испарения
3) имеется скачок физических свойств (плотность, вязкость, сопротивление, показатель преломления).
Участок изотермы правее точки с соответствует однофазному состоянию ненасыщенного пара, а левее - однофазному состоянию жидкости.
На критической ИТ выделяется критическая точка с критическим давлением ркр и критическим объемом Vкр, к которой сходятся с и е. Критические параметры Ткр, ркр и Vкр характеризуют вещество (см. таблицу).
| Ткр, К | ркр, атм | Vкр, см3 / моль | |
| Не | 5, 19 | 2,27 | |
| Н2 | |||
| N2 | |||
| Аr | |||
| O2 | |||
| СО2 | |||
| Пропан С3Н8 (баллонный газ) | |||
| Н20 |
На ИТ критическая точка является точкой перегиба и касательная к ней горизонтальна.
При температурах Т > Ткр и при давлениях р > ркр двухфазное состояние не наблюдается, При этом: 1) происходит плавное, без скачков, изменение свойств вещества от свойств газа к свойствам жидкости;
2) при Ткр исчезает граница раздела П-Ж;
3) при Ткр превращается в ноль теплота испарения.

Набор изотерм ВДВ


Притяжение молекул и зависимость сил притяжения от
расстояния между молекулами

Возникновение дополнительного давления
 Как соотносятся ИТ ВДВ типа 3 с ИТ реального газа при Т < Ткр?
Как соотносятся ИТ ВДВ типа 3 с ИТ реального газа при Т < Ткр?
Участок 1-2 соответствует участку abc – пар.
|
|
|
Участок 6-7 – жидкость.
Точки 2 и 6 (давление рн) выбирают так, чтобы площади фигур 2-3-4 и 4-5-6 были равны. Тогда участок 2-6 соответствует двухфазному состоянию, хотя его точки не удовлетворяют уравнению ВДВ.
Участок 2-3 есть на ИТ ВДВ и отсутствует на ИТ реального газа, но тем не менее может наблюдаться на опыте как состояние пересыщенного пара. Давление пересыщенного пара больше, чем давление насыщенного пара при заданной температуре. Это состояние не равновесное (ИТ реального газа описывает равновесные состояния), а метастабильное. Его существование связано с тем, что конденсация, а особенно процесс образования зародышей конденсации, требует времени, а при быстром охлаждении пара система не успевает прийти в равновесное двухфазное состояние.
Участок 5-6 также есть на ИТ ВДВ и отсутствует на ИТ реального газа, но соответствующее ему метастабильное состояние может наблюдаться в виде перегретой жидкости. При быстром нагреве чистой жидкости давление пара над ней не успевает достичь давления насыщенного пара.
Участок 3-4-5 не наблюдается на опыте – он является даже не метастабильным, а механически неустойчивым участком: на нем давление уменьшается при сжатии.
 Участок с p < 0 низкотемпературных ИТ ВДВ типа 4 может наблюдаться на опыте как метастабильное состояние растянутой жидкости.
Участок с p < 0 низкотемпературных ИТ ВДВ типа 4 может наблюдаться на опыте как метастабильное состояние растянутой жидкости.
Поправки ВДВ связаны с критическими параметрами соотношениями:
Vкр = 3 b pкр = a / (27 b2) Ткр = 8a / (27 R b).

Фазовый переход (испарение) при изменении объема и постоянной температуре

То же при постоянном давлении, стрелка показывает изменение объема при увеличении температуры

Изменение температуры вещества при нагреве вблизи фазовго перехода 1 рода
| Температуры и теплоты испарения | Т, К | DQ | ||
| Дж/г (уд) | кДж/моль | эВ/молек. | ||
| H2O | 40.7 | 0.45 | ||
| N2 | 5.6 | 0.06 | ||
| C6H6 | 40.8 | 0.45 | ||
| Hg | 56.9 | 0.6 | ||
| He | 4.2 | 0.1 | 0.001 | |
| C2H5OH | 35.5 | 0.4 |

Изменение температуры вещества при нагреве вблизи фазового перехода 2 рода

Изменение теплоемкости вещества вблизи точки фазового перехода 2 рода (λ точки)

Зависимость давления насыщенного пара от температуры.
К выводу уравнения Клапейрона-Клаузиуса
|
|
|
Для этого мы рассмотрим ТМ, которая работает по обратимому циклу 1234, использует в качестве рабочего тела 1 моль квазиравновесной смеси Ж + Г и имеет холодильник с Тх = Т - DТ и нагреватель с Тн = Т.
 Диаграмма этого цикла имеет вид:
Диаграмма этого цикла имеет вид:
Т.к. цикл обратимый, то его КПД:
h = А / QH = (Тн - Тх) / Тн = DТ / T
Работа в цикле А равна площади трапеции 1234:
А = DрН (VГ - VЖ),
а QH равна молярной теплоте испарения DQ.
DТ / T = DрН (VГ - VЖ) / DQ
Переходя от приращений к дифференциалам:
dрН/dT = DQ / (VГ - VЖ)T - это уравнение Клапейрона-Клаузиуса.

Продолжение изотермы пар-жидкость в область более высоких давлений и новый фазовый переход жидкость-кристалл

Кривые фазовых равновесий с критической точкой и тройной точкой
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 619; Нарушение авторских прав?; Мы поможем в написании вашей работы!