
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вводная лекция. Согласно этой теории, нельзя назвать точку пространства, где находится электрон
F
D
P
S
L + 1
Х.Рх h
Согласно этой теории, нельзя назвать точку пространства, где находится электрон. Можно говорить только о вероятности нахождения его в данном объеме.
Движение электрона в атоме как в трехмерном пространстве описал австрийский ученый Э. Шредингер (1926 г):
-
U – потенциальная энергия;
Е – полная энергия;
m – масса частицы;
 - волновая функция
- волновая функция
 - плотность вероятности; служит мерой вероятности нахождения электрона в сферическом слое между r и dr от ядра. Чем больше
- плотность вероятности; служит мерой вероятности нахождения электрона в сферическом слое между r и dr от ядра. Чем больше  , тем больше вероятность нахождения электрона в данной области атомного пространства.
, тем больше вероятность нахождения электрона в данной области атомного пространства.
Вместо «орбита» в данном случае используют термин «орбиталь» - волновая функция электрона (пространство вокруг ядра, в котором наиболее вероятно нахождение электрона).

7) Квантовые числа и атомные орбитали
Решение уравнения Шредингера для атома водорода дает три безразмерных параметра, которые называют квантовыми числами. Они показывают характер, геометрические особенности электронного облака.
Обозначения:
n – главное квантовое число
l – орбитальное квантовое число
ml – магнитное квантовое число
К квантовым числам относят также:
mS – спиновое квантовое число (оно не связано с характеристикой орбитали, а характеризует сам электрон).
1. Главное квантовое число n – характеризует энергию электрона и размеры электронного слоя
n – определяет расположение электрона на энергетическом уровне (слое):
Энергетический уровень – это совокупность электронов с одинаковыми значениями n.
n = 1- .
.
Обозначения уровней:
| n | |||||||
| Обозначение | K | L | M | N | O | P | Q |
n = 1 – первый энергетический уровень, энергия минимальна. Электроны других уровней обладают большим запасом энергии и их легче оторвать от ядра (чем больше n, тем легче отрыв).
Наибольшее число электронов на энергетическом уровне (следствие из принципа Паули:
N = 2n2
| n | N |
n – показывает число узловых поверхностей орбитали (где плотность электронного облака равна 0, то есть  =0 и электрон не может находиться).
=0 и электрон не может находиться).
2. Орбитальное квантовое число l – характеризует форму электронного облака (его геометрические особенности).
l изменяется от 0 до (n – 1); соответственно, l = 0,1,2,…, n - 1.
l – показывает номер электронного подуровня (характеризует расщепление уровней на подуровни):
n = 1 l = 0
n = 2 l = 0,1
n = 3 l = o,1,2,
n = 4 l = 0,1,2,3.
Подуровень (оболочка) – совокупность электронов данного уровня, характеризующихся одинаковым значением l.
l – показывает число узловых поверхностей орбитали, проходящих через ядро.
Максимальное число электронов в подуровне:
2(2 l +1)
Энергетические подуровни обозначают буквами:
| l, значения | ||||||
| l, обозначения | s | p | d | f | g | h |
| Максимальное число электронов |
Формы орбиталей:
l = 0 s - орбиталь (поверхность не проходит через ядро)

l =1 p -орбиталь (проходит через ядро одна поверхность).
Может быть три вида p -орбиталей: px, py и pz. Они образуют р -подуровень.

l = 2 d – орбиталь (проходят через ядро 2 поверхности).
Может быть пять видов d - орбиталей: dyz, dxy , dxz, dx2-y2 , dz2.
Они образуют d – подуровень.
Каждой форме электронного отвечает значение орбитального (механического) момента количества движения:
Мl = 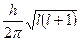 .
.

3. Магнитное квантовое число ml – характеризует расположение (ориентацию) орбитали в пространстве. В магнитном или электрическом поле происходит расщепление энергетических подуровней электрона.
Значения ml изменяются от - l до + l. Число возможных значений ml:
Столько же видов (расположений) орбиталей в данном подуровне.
| Подуровень | Обозначение | Значение ml | Число расположений орбиталей |
| l = 0 l = 1 l = 2 l = 3 | s p d f | -1; 0; +1 -2;-1;0;+1;+2 -3;-2;-1;0+1;+2;+3 |
Состояние электрона в атоме, характеризующееся определенными значениями n, l, ml называется атомной электронной орбиталью.
4. Спиновое квантовое число (спин) ms – условно характеризует вращение электрона вокруг собственной оси
Имеет два значения: + и -
и - .
.
Векторная величина: 
 (условные обозначения).
(условные обозначения).
Электроны, имеющие одинаковое направление спина mS = + или mS = -
или mS = -
называются параллельными, противоположное – антипараллельными. Два электрона, находящиеся на одной орбитали, отличаются друг от друга значениями m S. Они называются спаренными  . Один электрон
. Один электрон  или
или  - неспаренными. На орбитали может находится не более 2-х электронов с противоположными спинами.
- неспаренными. На орбитали может находится не более 2-х электронов с противоположными спинами.
Число орбиталей на подуровне:
| Подуровень | Число орбиталей |
| s p d f |
Обозначения:

|

| 
| 
|

| 
| 
| 
| 
|

| 
| 
| 
| 
| 
| 
|
8) Многоэлектронные атомы. Размещение электронов в атомах
Общая характеристика состояния электрона в атоме регулируется принципом Паули (1925 г.)
В любой атомной или молекулярной системе не может быть двух электронов, которые характеризовались бы одинаковыми значениями всех четырех квантовых чисел.
Порядок заполнения электронами атомных орбиталей (АО) определяется правилами Клечковского В.М. (минимальном значении энергии, определяемым значением n или l).
1. С ростом атомного номера элемента электроны размещаются последовательно на орбиталях, характеризуемых возрастанием суммы главного и орбитального квантовых чисел (n и l);
2. При одинаковых значениях суммы (n + l) электроны заполняют подуровни с меньшим значением n (большим значением l).
1s < 2s < 2p < 3s < 3p < 4s  3d < 4p <5s
3d < 4p <5s  4d < 5p < 6s
4d < 5p < 6s  5d
5d  4f < 6p и т.д.
4f < 6p и т.д.
| Обозначение | 1s | 2s | 2p | 3s | 3p | 4s | 3d | 4p | 5s | 4d | 5p | 6s | 5d | 4f | 6s |
| Сумма (n +l) |
При заполнении подуровней соблюдается правило Хунда:
Минимальной энергии соответствует такое распределение электронов в АО данного подуровня, при котором абсолютное значение суммарного спина атома максимально.
При любом другом размещении атом будет находиться в возбужденном состоянии.
Пример:
6 электронов в d-подуровне
1) Верно

| 
| 
| 
| 
|
mS = 5 . 
2) Неверно

| 
| 
| 
| 
|
mS = 3 . 
Размещение электронов характеризуется формулами, в которых:
- номер уровня обозначается цифрами;
- номер подуровня обозначается буквами;
- число электронов обозначается верхними индексами у букв.

1. Источники конституционного права зарубежных стран.
2. Основные школы науки конституционного права.
|
|
Дата добавления: 2014-01-13; Просмотров: 1389; Нарушение авторских прав?; Мы поможем в написании вашей работы!