
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сходство растворов ВМС и гидрофобных золей
|
|
|
|
n 1. ВМС медленно диффундируют.
n 2. ВМС не проникают через полупроницаемые мембраны.
n 3. Размер частиц ВМС соответствует коллоидным [1–100 нм].
n Отличие растворов ВМС от гидрофобных золей:
n 1. как растворы НМС, обладают термодинамической устойчивостью.
n 2. обладают обратимой растворимостью. Гидрофобные золи необратимы.
n 3. Растворы ВМС являются истинными растворами, не имеющими поверхности раздела; гидрофобные золи имеют поверхность раздела.
n 4. ВМС самопроизвольно растворяются в определённых жидкостях, не требуя стабилизаторов и затраты внешней энергии.
n Для получения растворов ВМС применяют метод растворения или самопроизвольного диспергирования.
n
n Специфические свойства ВМС.
n 1. ВМС набухают. Набухание сопровождается увеличением массы и объёма полимера.
n 2. Растворы ВМС обладают большой вязкостью. 3. Растворы ВМС легко желатинируются, образуя гели.
n 4. ВМС лиофильны, а биополимеры гидрофильны.
n 5. Растворы ВМС более устойчивы, чем растворы гидрофобных коллоидов, и поэтому могут быть получены более концентрированными.
n 6. Растворы ВМС сами не седиментируют.
n 7. В растворах ВМС может иметь место коацервация. Это слияние водных оболочек частиц без объединения самих частиц.
n 8. ВМС [белки] могут подвергаться денатурации.
n 9. ВМС [белки] подвергаются высаливанию.
n 10. ВМС дают размытый конус Тиндаля; гидрофобные золи дают чёткий конус Тиндаля.
n Гидрофильность растворов биополимеров.
n ☻Гидрофильность искусственных полимеров обусловлена двойными связями, аминными и спиртовыми группировками.
n ☻Гидрофильность природных полимеров обусловлена главным образом пептидными, эфирными, двойными связями, карбоксильными, карбонильными, спиртовыми и аминными группами.
|
|
|
n ☻Различают диссоциированные [ионогенные] гидрофильные группы и недиссоциированные [полярные] группы.
l Ионогенные гидрофильные группы: R—СООН, R—СООNa, R—NН3ОН, R—NH3Cl.
l Недиссоциированные [полярные] гидрофильные группы: R2-C=0; R-COH
l ☻Диссоциация ионогенных групп обеспечивает ВМС электрический заряд, а полярные группы притягивают диполи воды, образующие гидратную оболочку. Устойчивость растворов ВМС определяется двумя факторами:
l - наличием заряда
l - наличием гидратной оболочки
l Аномальная и структурная вязкость растворов ВМС.
l Вязкость — это внутреннее трение, обусловленное силами сцепления между молекулами жидкости.
l Для растворов ВМС- высокая вязкость;
l.
l Согласно П закону Пуазейля, вязкость растворов прямо пропорциональна внешнему давлению, действующему на протекающую жидкость, но
l ВМС не подчиняются этому закону; в растворах ВМС обнаруживается так называемая аномальная вязкость (а.в.)
• Аномальной её называют потому, что:
• 1/ эта вязкость очень высока;
• 2(а.в.) уменьшается с увеличением давления на протекающую жидкость.
• Причина (а.в.) - силы сцепления гидрофильных молекул ВМС с молекулами воды очень велики.
• Располагаясь поперёк потока, крупные частицы ВМС оказывают сопротивление и увеличивают вязкость. При увеличении внешнего давления на жидкость эти частицы ориентируются вдоль потока и вязкость раствора уменьшается.
• Аномальную вязкость называют ещё и структурной вязкостью,
n Вязкость зависит:
n 1. От природы полимера [с повышением молекулярной массы вязкость растворов полимеров возрастает; у полимеров с выпрямленными цепями вязкость выше, чем у полимеров со свёрнутыми, клубкообразными молекулами].
n 2. Вязкость зависит от природы растворителя, так как определяется силами сцепления между молекулами ВМС и молекулами растворителя.
|
|
|
n 3. Вязкость зависит от концентрации [с повышением концентрации вязкость сильно возрастает, так как между молекулами полимера легче образуются структурные сетки].
n 4. Вязкость растворов ВМС всегда падает с ростом температуры. Это объясняется интенсивностью молекулярного движения, разрушающего структуры.:
l 5. На вязкость раствора ВМС влияет время приготовления раствора [при старении вязкость возрастает!].
l 6. На вязкость влияет рН раствора. В ИЭТ растворы биополимеров имеют более компактную форму макромолекул и наименьшую вязкость.
l 7. На вязкость влияет добавление минеральных веществ:
l а/ примеси солей кальция повышают вязкость многих полимеров [например, желатина];
l б/ анионы располагаются в прямой лиотропный ряд по своему действию[SO4 2– повышает вязкость, CNS– снижает].
l 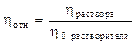 Различают относительную, удельную, приведённую и характеристическую вязкость.
Различают относительную, удельную, приведённую и характеристическую вязкость.
l Относительная вязкость:
l 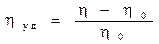 Удельную вязкость:
Удельную вязкость:
l или ηуд = ηотн – 1, где
l η — вязкость раствора;
l 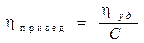 η0 — вязкость растворителя.
η0 — вязкость растворителя.
l Приведённая вязкость:
l 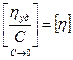 С→0, можно получить величину, называемую предельной приведённой вязкостью или характеристической вязкостью:
С→0, можно получить величину, называемую предельной приведённой вязкостью или характеристической вязкостью:
l где [η] — характеристическая вязкость.
l Штаудингер
l ηуд = К • М • С, где
l К — константа, характерная для данного гомологического ряда полимеров, не зависящая от природы растворителя.
l Определяют М лишь только для коротких цепей или более жёстких.
n Строение ДНК.
n 1. Первичная структура ДНК представлена последовательностью мононуклеотидов, соединённых между собой сложноэфирными связями.
n 2. Уотсон и Крик-
n молекула ДНК состоит из двух правозакрученных антипараллельных полинуклеотидных спиралей, имеющих общую ось, так что образуется двойная спираль [ вторичная структура ДНК ]. Цепи связаны по правилу комплементарности:
n аденин с тимином 2 водородными связями,
n гуанин с цитозином — 3 водородными связями.
n снаружи молекулы находятся остатки фосфорной кислоты, заряженные отрицательно [Р—О–], внутри – азотистые основания..
n основа принципа комплементарности --связь приводящая к образованию двойной спирали одинакового диаметра, наиболее выгодна для системы с энергетической точки зрения.
|
|
|
n 3. В хромосомах молекулы ДНК далее способны образовывать компактную структуру [ третичная структура ДНК ]
n 4. В комплексе с белками (гистонами)[ четвертичная структура ДНК ].
n фракция Г3 гистонов легко помещается в малом желобке двойной спирали ДНК.
n Г1 гистонов тяжело совмещается с ДНК и нейтрализует фосфорные группы в отдельных точках. Роль этой фракции — образование надмолекулярной структуры: соединение ДНК-частиц.
n Система хромосом — это надмолекулярная система; очевидно, в хромосоме молекулы ДНК находятся в виде субъединиц.
n Белки.
n 1. Основным фактором, определяющим структуру белка, является последовательность аминокислот, - первичная структуры белка. В первичной структуре белка атомы связаны прочными ковалентными связями.
n 2. Под вторичной структурой белка понимают конфигурацию полипептидной цепи в пространстве- В 1951 г. Полинг и Кори (спиральная конфигурация).
n Дисульфидные мостики, но основную роль играют водородные связи.
n белки [β-кератин волос, фиброин шёлка] образуют не α-спираль, а β‑структуру. Они имеют несколько полипептидных цепей, расположенных параллельно.
n 3. Трёхмерная конфигурация полипептидной спирали или β-структуры в пространстве определяет её третичную структуру: закручивается в клубок α‑спираль, и β-структура. Так образуется глобулярная структура [у глобулярных белков].
n У фибриллярных [нитевидных] белков третичная структура характеризуется:
n а/ объединением α-спиралей в многожильный пучок —вторичную спираль;
n б/ объединением лент β-структур в многослойную ленту.
n Третичную структуру поддерживают:
n 1. Ионные связи.
n 2. Водородные связи.
n 3. Дисульфидные связи.
n 4. Ван дер Ваальсово взаимодействие.
n 5. Взаимодействие полярных групп с водой.
n.4. По Берналу четвертичная структура представляет собой комплекс субъединиц, способных к диссоциации. и поддерживается теми же связями и силами, что и третичная структура.
|
|
|
n Молекулярная масса белков и методы её определения.
n Миоглобин — 16 900
n Гемоглобин — 68 000
n Растительный вирус — 10 600 000
n Неточно М определяют:
n π осм.= CRT= m/ M RT
n криоскопический метод ∆t зам. = m/M∙Kкр; (Kкр=1.85 для Н2О)
n 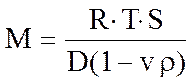 Наиболее точными - рентгеноструктурный анализ и метод ультрацентрифугирования.
Наиболее точными - рентгеноструктурный анализ и метод ультрацентрифугирования.
n, где
n R — газовая постоянная;
n Т — абсолютная температура;
n S — константа, выражающая скорость седиментации;
n D — коэффициент диффузии;
n ρ — плотность среды;
n V — увеличение объёма при добавлении 1 г белка, или удельный объём
n
n Методы определения иэоэлектрической точки белков.
n Изоэлектрическая точка белков может быть определена следующими методами:
n 1. По величине набухания - Наименьшее набухание будет в изоэлектрической точке.
n 2. По скорости желатинирования. Быстрее всего желатинирование происходит в изоэлектрической точке.
n 3. По степени коагуляции -Наиболее выраженное помутнение раствора будет в изоэлектрической точке.
n 4. По электрофоретической подвижности -В растворе, где рН соответствует изоэлектрической точке белка, белок будет электронейтральным и перемещаться в электрическом поле не будет.
n 5. Потенциометрическое титрование в сочетании с определением максимальной степени коагуляции.
n Свойства белка в ИЭТ.
n Минимальны:
n 1/ вязкость;
n 2/ гидратация;
n 3/ набухание;
n 4/ растворимость;
n 5/ осмотическое давление;
n 6/ электропроводность;
n 7/ дзета-потенциал.
n Максимальны:
n 1/ степень коагуляции;
n 2/ желатинирование
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 1833; Нарушение авторских прав?; Мы поможем в написании вашей работы!