
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Страдает внеклеточное пространство- при потере крови
|
|
|
|
3.Гипотоническая дегидратация
Р осм ß жидкость ß
клетка пересыщается водой – при потери натрия, который удерживает воду.
u 4. Гипертоническая гипергидратация
u Р осм Ý жидкость Ý
u клетка обезвоживается- если нет пресной воды
u 5. Изотоническая гипергидратация
u Р =N жидкость Ý
u отеки при циррозе печени, ССЗ
u 6. Гипотоническая гипергидратация
u Р осм ß жидкость Ý
u чрезмерное потребление воды, поражаются клетки
u Методы криоскопии и эбулиоскопии используются для определения молекулярной массы веществ:
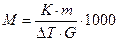 |
u, где
u М — молекулярная масса растворённого вещества;
u К — эбулиоскопическая или криоскопическая константа;
u m — масса растворённого вещества в г [или кг];
u G — масса растворителя в г [или кг];
u Осмолярность плазмы крови взрослого человека в норме 275-300 мосм/кг воды.
u  Можно определить осмолярную концентрацию любой биологическлой жидкости, если известна точка её замерзания:
Можно определить осмолярную концентрацию любой биологическлой жидкости, если известна точка её замерзания:
u.
u Равновесие между раствором и осадком малорастворимого сильного электролита.
u Са3(РО4)2 ↓↔ 3Са 2+ + 2PO4 3-.
u Применяя закон действующих масс для данного равновесного состояния, выразим константу растворимости КS (произведение растворимости (ПР)):
u ПР = [Са 2+ ] 3[PO4 3- ]2 / [Са3(РО4)2 ].
u [Са3(РО4)2 ] = const, и ПР(Са3(РО4)2)= [Са 2+ ] 3[PO4 3- ]2.
u Чем меньше ПР, тем ниже растворимость электролита.
u Условия образования осадка: стехиометрическое произведение концентраций ионовсильного электролита должно быть больше ПР:
u [Са 2+ ] 3[PO4 3- ]2 > ПР.
u Условия растворения осадка: осадок малорастворимого сильного электролита растворится, когда стехиометрическое произведение концентраций ионовсильного электролита меньше ПР:
|
|
|
u [Са 2+ ] 3[PO4 3- ]2 < ПР.
u Последовательность осаждения ионов: если к раствору, содержащему смесь ионов, осаждаемых одним и тем же реагентом, добавить этот реагент, то образование осадков идет поочередно, начиная с электролита, имеющего наименьшее ПР.
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 289; Нарушение авторских прав?; Мы поможем в написании вашей работы!