
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Открытая c— обменивается с окружающей средой и массой, и энергией
|
|
|
|
Закрытая с — обменивается со средой лишь энергией,
Изолированная система не обменивается с окружающей средой ни массой, ни энергией.
n Термодинамическими параметры:
n экстенсивные параметры (объём, масса) и
n интенсивные параметры (температура, давление, вязкость, концентрация и т.д.).
n.
n процессы,
n - ---происходящие при постоянном объёме — изохорные,
n --- при постоянном давлении — изобарные
n - ---при постоянной температуре — изотермические.
• Термодинамические функции состояния –
• 1. U – внутренняя энергия – сумма потенциальной энергии взаимодействия всех частиц в системе и кинетической энергии их движения.
• 2. S – энтропия -мера неупорядоченности в системе, т. е. неоднородности расположения и движения частиц.
S=k∙lnW;
k - постоянная Больцмана.
W – термодинамическая вероятность,
• Для химических реакций справедливо:
• Δ S0 р-ии = ΣΔ S0i (продуктов) - ΣΔ S0i (исходных веществ).
n Н – энтальпия – теплосодержание системы.
n.
n QР = -Δ Н.
n Изменение энтальпии при стандартных условиях - Δ Но.
n Для определения Δ Но реакции справедливо:
n Δ Н0 р-ии = Σ Δ Н0i (продуктов) - Σ Δ Н0i (исходных веществ).
n G - энергия Гиббса –в кДж/моль по формуле:
n ΔG° = Δ Н0 - ТΔS0:
n для простых веществ ΔG° = 0,
n ΔG 0 реакции = Σ ΔG 0i (прод.) - Σ ΔG 0i (исх. В-в).
n Термохимия - это раздел химии, изучающий тепловые эффекты химических процессов.
n I закон термохимии Лавуазье-Лапласа гласит:
n Тепловой эффект образования данного соединения равен тепловому эффекту его разложения, но имеет противоположный знак.
n II закон термохимии Гесса:
n Тепловые эффекты химических реакций, зависят только от природы и состояния исходных веществ и конечных продуктов и не зависят от промежуточных реакций
|
|
|
n Из закона Гесса вытекают 2 следствия:
n 1 следствие: тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции (S DН˚ прод.) и суммой теплот образования исходных веществ (S DН˚ исх.в-в), взятых с соответствующими стехиометрическими коэффициентами.
n Математическое выражение этого следствия:
n DН˚ = S DН˚ прод. – S DН˚ исх.в-в
n 2 следствие: тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции, взятых с учётом стехиометрических коэффициентов.
• Первый закон термодинамики
• Для изолированных систем: внутренняя энергия т.с. постоянна (∆U=0).
• Для закрытых систем: сообщаемая системе теплота расходуется на увеличение внутренней энергии и совершение работы против внешних сил: т. е. Q=∆U+A=∆U+P∆V.
• В изохорном процессе (V= const) A=0, тогда QV =∆U
• В изобарном процессе (р=const).
• QР=∆H, т.е
• В открытых биологических системах Q=∆U-A
• Второй закон термодинамики:
• самопроизвольно могут протекать только такие процессы, в результате которых ∆G<0.
• Реакции, для которых
• ----∆G<0 называются экзергонические,
• ----∆G>0 – эндергонические.
•
• Химическое равновесие.
• необратимые - идут в одном направлении до полного израсходования одного из реагирующих веществ.
• обратимые – одновременно могут протекать две взаимно противоположные реакции.
• Обратимые реакции заканчиваются наступлением химического равновесия, когда Vпр = Vобр и G→min (значит ∆G→0);
• смещение равновесия (в соответствии с принципом Ле-Шателье:
• если на систему, находящуюся в состоянии химического равновесия подействовать изменением внешних факторов (P,C,T), то в системе усилится тот процесс, который препятствует этому воздействию.
|
|
|
• По величине Кр можно судить о направлении и глубине процесса в данных условиях.
• lgКр=-ΔG0 / 2,3RT
• Если Кр>1 равновесие смещено вправо (ΔG0р-ции<0).
• Если Кр<1 равновесие смещено влево (ΔG0>0)
• Если Кр=1 система находится в состоянии равновесия (ΔG0=0).
• В живом организме (открытая система) вместо термодинамического равновесия наступает стационарное состояние, которое характеризуется не равенством прямого и обратного процессов, а постоянством скорости химических изменений и отводом метаболитов.
• В 1946-1960 гг. И.Пригожин:
• Стационарное состояние ЖО соответсвет минимальный прирост энтропии: dS→ min
• dS=dSl +dSi
• dSl Ð0 внутри организма
• dSi >0 изменение при связи с внешней средой
• /dSl/> / dSi /
• Химическая кинетика — это учение о скорости и механизме химических реакций.
• 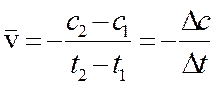 Скорость химической реакции — это количество элементарных актов взаимодействия в единицу времени в единице объёма [для гомогенной среды] или на единице поверхности раздела фаз [в гетерогенной среде].
Скорость химической реакции — это количество элементарных актов взаимодействия в единицу времени в единице объёма [для гомогенной среды] или на единице поверхности раздела фаз [в гетерогенной среде].
• Скорость гомогенной реакции зависит от:
• - природы реагирующих веществ;
• - концентрации реагентов;
• - температуры;
• - катализатора.
• ВЛИЯНИЕ ПРИРОДЫ РЕАГИРУЮЩИХ ВЕЩЕСТВ
• -----их состава (фтор и иод),
• -----вид частиц, которые участвуют в реакции: атомы, молекулы, ионы или радикалы.
ВЛИЯНИЕ КОНЦЕНТРАЦИИ РЕАГЕНТОВ -
• законом действующих масс (1867 г. К.М.Гульдберг и П.Вааге.):
• Скорость простой гомогенной реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, численно равные их стехиометрическим коэффициентам.
• aA + bB = dD
• v = K • CА a • CВ b,
• где К — константа скорости -численно равна скорости при концентрации в-в равной 1 моль/л.
• Молекулярность — это минимальное число различных частиц, участвующих в элементарном акте химического взаимодействия.
• СН 4 → С + 2Н 2 -мономолекулярная
• Н 2 + I 2 → 2HI - би
• 2KMnO 4 + 5H 2 C 2 O 4 + 3H 2 SO 4 → K 2 SO 4 + 2MnSO 4 + 8H 2 O + 10CO 2 три
• Порядок реакции — это сумма показателей степеней в математическом выражении закона действия масс:
|
|
|
• aA + bB = dD
• v = K • CА a • CВ b,
• n = a + b … — общий порядок реакции.
• Показатель степени при какой-либо одной концентрации определяет порядок реакции по данному компоненту. Например, а — показывает порядок реакции по компоненту А и т.д.
• Различают реакции I порядка: С + О 2 = СО 2 v = K[O 2 ]
• В реакциях II порядка скорость:
• H 2 + I 2 = 2HI v = K[H 2 ][I 2 ] уравнение II порядка: 1 + 1 = 2
• 2Н 2 О ↔ 2Н 2 + О 2 v = K[H 2 O] 2
• прямая реакция II порядка, а обратная — III порядка: v = K[H 2 ] 2 [O 2 ] 2 + 1 = 3
• Реакция III порядка в газовой фазе — окисление оксида азота [II]:
• 2NO + O 2 → 2NO 2
n фотохимические реакции — реакции, происходящие под действием лучей света [видимых, инфракрасных, ультрафиолетовых].
n Эффективность фотохимической реакции определяется так называемым квантовым выходом γ:
n γ = число молекул продукта реакции
n Фотохимические реакции бывают различных типов: а/ синтез вещества [фотосинтез] и б/ разложение веществ под действием света [фотолиз:
n hν
n 2HCl → H 2 + Cl 2
n Фотосинтез, происходящий в растениях — сложный окислительно-восстановительный процесс, сочетающий фотохимические реакции с ферментативными.
n |
n CO2 + 2H2O → [H—C—OH]n + O2
n |
Влияние температуры:
n Правило Вант-Гоффа [1884] читается так:
n 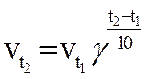 При повышении температуры на 10˚ скорость химической реакции увеличивается в 2-4 раза.
При повышении температуры на 10˚ скорость химической реакции увеличивается в 2-4 раза.
Где v t2 — скорость реакции при конечной температуре;
v t1 — скорость реакции при начальной температуре;
γ — температурный коэффициент, зависящий от природы реагирующих веществ
Cl2 + hν = Cl• + Cl•
H2 + Cl• = HCl + H•
H• + Cl2 = HCl + Cl•
• В 1889 г. С.Аррениус предположил, что влияние температуры сводится к увеличению числа активных молекул
 |
• где
• К — константа скорости реакции;
• е — основание натуральных логарифмов,
• Т — абсолютная температура,
• R — газовая постоянная;
• Еакт — энергия активации [кДж/моль],
• А — предэкспоненциальный множитель или коэффициент, равный общему числу соударений за единицу времени в единице объёма.
n
n
n
n
n
|
|
|
n
n
n
n Активированный комплекс — конфигурация атомов, в которой ослаблены старые связи и образуются новые [синтез йодистого водорода]:
n H I H……I H—I
n | + | → ¦ ¦ →
n H I H……I H—I
n Энергия активации — это минимальная энергия, достаточная для осуществления акта химического взаимодействия. Энергия активации необходима для возникновения непрочного переходного комплекса

|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 599; Нарушение авторских прав?; Мы поможем в написании вашей работы!