
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантовомеханическая модель атома водорода
|
|
|
|
Рассмотрим описание атома водорода с точки зрения квантовой физики. Из стационарного уравнения Шредингера 
для атома водорода: 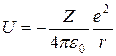 и, следовательно
и, следовательно
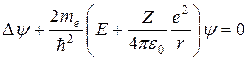 . (8.9)
. (8.9)
Так как поле, в котором движется электрон, является центрально-симметричным, то для решения уравнения (8.9) обычно используют сферическую систему координат: r, q, j. Тогда уравнение Шредингера примет вид:
 . (8.9¢)
. (8.9¢)
В теории дифференциальных уравнений доказывается, что уравнения такого типа имеют решения, удовлетворяющие требованиям однозначности, конечности и непрерывности волновой функции, только при собственных значениях энергии
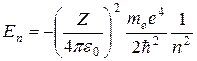 , n = 1, 2, 3,… (8.10)
, n = 1, 2, 3,… (8.10)
При Е < 0 движение электрона является связанным и по мере роста n энергетические уровни располагаются теснее. При Е > 0 электрон становится свободным. Энергия ионизации атома (n = 1) 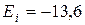 эВ.
эВ.
Выражение (8.10) совпадает с формулой, полученной Бором для энергии водорода. Однако, если Бору пришлось вводить дополнительные гипотезы, то в квантовой механике дискретные значения энергии следуют непосредственно из решения уравнения Шредингера.
В квантовой механике доказывается, что уравнению Шредингера (8.9¢) удовлетворяют собственные функции  , определяемые тремя квантовыми числами n, l, m.
, определяемые тремя квантовыми числами n, l, m.
Главное квантовое число n определяет энергетические уровни электрона в атоме: n = 1, 2, 3,…
Из решения уравнения Шредингера следует, что момент импульса (механический орбитальный момент) электрона квантуется
 , (8.11)
, (8.11)
l - азимутальное или орбитальное квантовое число (определяет момент импульса электрона в атоме) l = 0, 1, 2, …, (n – 1), т.е. всего n значений.
Проекции вектора момента импульса 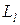 на выделенное направление z внешнего магнитного поля:
на выделенное направление z внешнего магнитного поля:
 , (8.12)
, (8.12)
m – магнитное квантовое число (определяет проекцию момента импульса на заданное направление) m = 0, ± 1, ±2, …, ± l, т.е. всего (2 l + 1) ориентаций.
|
|
|
Хотя энергия электрона зависит только от n, каждому собственному значению  соответствует несколько собственных функций
соответствует несколько собственных функций  , отличающихся l и m. Следовательно, атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях. Состояния с одинаковой энергией называются вырожденными, а число различных состояний с каким-либо значением энергии кратностью вырождения.
, отличающихся l и m. Следовательно, атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях. Состояния с одинаковой энергией называются вырожденными, а число различных состояний с каким-либо значением энергии кратностью вырождения.
Так как для данного n орбитальное квантовое число может изменяться от 0 до n - 1, а m принимает всего  значений, то число различных состояний, соответствующих каждому n:
значений, то число различных состояний, соответствующих каждому n: 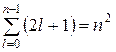 .
.
Квантовые числа и их значения являются следствием решения уравнения Шредингера и налагаемых на волновую функцию условий. Более того, в связи с волновыми свойствами электронов, квантовая механика вообще отказывается от классических представлений об электронных орбитах. Согласно квантовой механике, каждому энергетическому состоянию соответствует волновая функция, квадрат модуля которой определяет вероятность обнаружения электрона в единице объема.
Вероятность обнаружения электрона в различных частях атома различна. Электрон при своем движении как бы “размазан” по всему объему, образуя электронное облако, плотность которого характеризует вероятность нахождения электрона в различных точках объема атома. Квантовые числа n и l определяют размер и форму электронного облака, а m его ориентацию в пространстве.
В атомной физике, по аналогии со спектроскопией, применяются условные обозначения состояний электрона с различными значениями момента импульса. Состояние электрона с l = 0 называют s – состоянием
l = 1 - p – состоянием
l = 2 - d
l = 3 - f
l = 4 - g
l = 5 - h и т.д.
Значение главного квантового числа n указывается перед условным обозначением l. Таким образом, возможны следующие состояния:
|
|
|
1S
2S 2P
3S 3P 3d
4S 4P 4d 4f
В квантовой механике вводятся правила отбора, ограничивающие число возможных переходов электронов в атоме, связанных с испусканием и поглощением света. Для дипольного излучения электрона, движущегося в центрально-симметричном поле ядра, могут осуществляться только такие переходы, для которых:
1. изменение орбитального квантового числа удовлетворяет условию
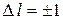 ;
;
2. изменение магнитного квантового числа удовлетворяет условию
 .
.
Пользуясь условными обозначениями состояний электрона можно описать спектр испускания (поглощения) атома водорода, полученный в теории Бора
серии Лаймана  )
)
Бальмера  и т.д.
и т.д.
Переход электрона из основного состояния в возбужденное обусловлен увеличением энергии атома, например за счет поглощения фотона. Атом не может поглотить только часть фотона, поскольку фотон, как и другие элементарные частицы, является неделимым. Поэтому атом будет поглощать только те фотоны, энергия которых в точности соответствует разности энергий двух его уровней. Так как поглощающий атом обычно находится в основном состоянии, то спектр атома водорода должен состоять из линий, соответствующих переходам 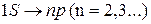 , что полностью соответствует опыту.
, что полностью соответствует опыту.
При увеличении n дискретность энергетических уровней уменьшается и характер поведения частицы приближается к классическому. В этом состоит принцип соответствия Бора (1923 г.):
При больших квантовых числах следствия, вытекающие из квантовой механики, должны совпадать с результатами классической теории.
Подобно тому, как при  релятивистская механика переходит в ньютоновскую, так и при
релятивистская механика переходит в ньютоновскую, так и при 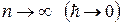 квантовая механика переходит в классическую (пренебрегаем
квантовая механика переходит в классическую (пренебрегаем 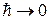 ).
).
Собственные функции уравнения (8.9¢) распадаются на 2 множителя:
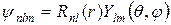 , где
, где  - вещественный множитель, а
- вещественный множитель, а  - комплексный.
- комплексный.
Так как r,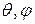 независимы, то их подстановка в уравнение Шредингера в сферических координатах, приводит к тому, что оно разбивается на две независимые части: радиальную
независимы, то их подстановка в уравнение Шредингера в сферических координатах, приводит к тому, что оно разбивается на две независимые части: радиальную 
и сферическую 
Первая часть зависит только от вида потенциальной энергии и, следовательно, определяется конкретной физической природой взаимодействия частиц (в нашем случае кулоновского). Вторая от вида силового поля не зависит, поэтому ее решение одинаково для всех центрально-симметричных полей.
|
|
|
Элемент объема в сферической системе координат  , можно представить в виде
, можно представить в виде 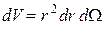 , где
, где  - телесный угол. Тогда вероятность нахождения электрона в элементе объема dV определяется как
- телесный угол. Тогда вероятность нахождения электрона в элементе объема dV определяется как 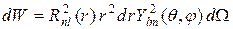 . Величина
. Величина  представляет собой плотность вероятности нахождения электрона на расстоянии r от ядра, а величина
представляет собой плотность вероятности нахождения электрона на расстоянии r от ядра, а величина 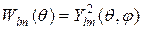 - есть плотность вероятности нахождения электрона на прямой, проходящей через ядро атома и образующей угол q с осью z. На рис. приведены графики плотности вероятности для атома водорода.
- есть плотность вероятности нахождения электрона на прямой, проходящей через ядро атома и образующей угол q с осью z. На рис. приведены графики плотности вероятности для атома водорода.
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 734; Нарушение авторских прав?; Мы поможем в написании вашей работы!