
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Показатели качества воды
|
|
|
|
В зависимости от характера использования воды различными потребителями определяются и показатели, необходимые для качественной и количественной характеристики воды. Важнейшими показателями качества воды для использования ее в теплоэнергетике являются:
1) концентрация грубодисперсных веществ (ГДП);
2) концентрация истинно-растворенных примесей (ионный состав);
3) концентрация коррозионно-активных газов;
4) концентрация ионов водорода;
5) технологические показатели, в которые входят сухой и прокаленный остаток, окисляемость, жесткость, щелочность, кремнесодержание, удельная электропроводимость и т. д.
Концентрация грубодисперсных веществ в воде может быть достаточно точно определена фильтрованием воды через бумажный фильтр с последующим его высушиванием при температуре 378—383 К до постоянной массы. Однако на практике предпочитают использовать методы определения грубодисперсных веществ по прозрачности и мутности воды.
Прозрачность воды определяют при повышенных концентрациях ГДП в воде при помощи стеклянной трубки, залитой водой, а дне которой расположен шрифт или крест с шириной линий 1 мм. Высота столба воды, при которой определяется хорошая видимость шрифта или креста, является количественной оценкой прозрачности воды. При малых концентрациях ГДП (<3 мг/кг) используют нефелометрический метод, основанный на сравнении мутности анализируемой воды с соответствующим эталоном. Концентрация ГДП может быть также определена по разности значений плотного и сухого остатков, полученных при упаривании I кг соответственно нефильтрованной и фильтрованной воды.
Сухой остаток позволяет косвенно судить о солесодержании моды, т. е. о сумме всех анионов и катионов в воде, за исключением ионов Н+ и ОН-. Однако при образовании сухого остатка несколько изменяется ионный состав примесей за счет отложения бикарбонатов. В сухой остаток входит также часть органических и коллоидных примесей. Прокаливание сухого остатка при 1073 К приводит к сгоранию органических примесей и распаду карбонатов. Поэтому разность значений плотного сухого остатков позволяет лишь ориентировочно оценить концентрацию органических примесей в воде. На практике предпочитают определять концентрацию органических примесей в воде косвенным методом, используя сильные окислители (пример, КМпО4). Поэтому концентрацию органических примесей называют окисляемостью воды и выражают через расход окислителя, необходимого в стандартных условиях для окисления органических примесей, содержащихся в 1 кг воды.
|
|
|
Концентрации отдельных ионов в воде, мг/кг (или мг-экв/кг), Определяют методами химического анализа. Правильность Проведения анализа должна подтверждаться выполнением закона электронейтральности  мг-экв/кг. Возможная ошибка при этом не должна превышать 1%:
мг-экв/кг. Возможная ошибка при этом не должна превышать 1%:
Если ошибка превышает 1%, то следует проверить качество анализа отдельных ионов или повторить весь анализ.
Суммарная концентрация всех катионов и анионов в воде составляет солесодержание воды, при этом не учитываются анионы кремниевой кислоты из-за неопределенности сведений об их концентрации в ионной форме, полуторные оксиды и ионы Н+ и ОН-. В случае крепких растворов ионы Н+ и ОН- следует учитывать при подсчете солесодержания.
Жесткость воды является одним из важнейших показателей, определяющих пути использования воды в теплоэнергетике. Общей жесткостью воды Жо называется суммарная концентрация ионов кальция и магния, выражаемая в мг-экв/кг, а при малых значениях — в мкг-экв/кг. По определяющему катиону общая жесткость воды подразделяется на кальциевую ЖСа и магниевую ЖMg. Часть общей жесткости, эквивалентная концентрации бикарбонат-ионов и карбонат-ионов в воде, называется карбонатной жесткостью Жk. а остальная часть, эквивалентная содержащимся в воде другим анионам (Сl-, SO2-4 и др.), называется некарбонатной жесткостью Жнк:
|
|
|
ЖCa ← Жо → ЖMg
Общей щелочностью воды Що, мг-экв/кг, называется суммарная концентрация всех анионов слабых кислот и ионов гидроксила за вычетом концентрации ионов водорода:
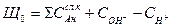
Характер анионов слабых кислот, обусловливающих общую, щелочность, позволяет подразделять ее на гидратную щелочность (равную концентрации ионов ОН-), бикарбонатную (HCO3-), карбонатную (СО3-), силикатную (HSiO3-, SiO32-) и фосфатную (Н2РО4-, HPO42-, PO43-).
Обычно в природных водах бикарбонатная щелочность существенно преобладает над другими видами щелочности, поэтому ее значение без большой погрешности выражает общую щелочность воды. Поправка на концентрацию ионов Н+ при определении щелочности вводится при присутствии в воде слабых кислот в свободном состоянии, так как при их диссоциации образуются в эквивалентных количествах анионы слабых кислот и анионы Н+.
Удельная электропроводимость воды, См/см, характеризуется электрической проводимостью слоя воды, находящегося между двумя противоположными гранями куба с ребром, равным 10-2 м. Она косвенно связана с суммарной концентрацией примесей в истинно-растворенном состоянии (солесодержанием). В чистой воде, не содержащей примесей, перенос зарядов осуществляется лишь ионами Н+ и ОН-. Удельная электропроводимость такой воды при 293 К составляет 0,04 мкСм/см. В растворах связь между электропроводимостью и концентрацией ионных примесей зависит от множества факторов, в том числе от температуры, вида ионов, степени диссоциации, что существенно затрудняет измерения. Более определенная связь существует в растворах при постоянных температуре и степени диссоциации.
Концентрация растворенных газов в воде зависит от множества факторов: природы газа, температуры воды, степени минерализации воды, парциального давления газа над водой, рН воды и т. п. Это во многих случаях существенно затрудняет их аналитическое определение в технологических процессах и требует специальных методов анализа. Концентрация СО2 в природной воде существенно зависит от степени углекислотного равновесия и составляет примерно 0,5 мг/кг (10-5 моль/кг) при 293 К. Концентрация О2 в значительной степени зависит от содержания в воде органических веществ и температуры. П|ри увеличении температуры от 273 до 308 К концентрация кислорода в чистой воде уменьшается от 14,6 до 6,5 мг/кг.
|
|
|
Классификация природных вод.
По солесодержанию природные воды разделяются на
- пресные (<1 г/кг);
- солоноватые (1—25 г/кг);
- соленые (>25 г/кг).
По значению общей жесткости, мг-экв/кг, природные воды классифицируются следующим образом:
- Жо<1,5—воды с малой жесткостью;
- Жо= 1,5 — 3—воды со средней жесткостью;
- Жо=3-6 —воды с повышенной жесткостью;
- Жо=6-12—воды с высокой жесткостью;
- Жо>12—воды с очень высокой жесткостью.
В основу классификации воды может быть положено и содержание соответствующих анионов. Все природные воды подразделяются по характеру преобладающего в воде аниона, на три класса:
1) гидрокарбонатные (в которых преобладает анион HCO3-);
2) сульфатные (преобладает SO42-);
3) хлоридные (преобладает С1-).
В свою очередь каждый класс подразделяется по преобладающему катиону на группы: кальциевую, магниевую, натриевую. По степени загрязненности органическими веществами природные воды можно разделить на четыре группы, характеризующиеся определенной окисляемостью, мг О2/кг: меньше 5—малая, 5— 10—средняя, 10—20—повышенная и свыше 20—сильная. Особенно богаты органическими веществами воды болотного типа, и наоборот, подземные воды весьма бедны органическими веществами. Окисляемость поверхностных вод существенно меняется в зависимости от сезона года. Максимальное содержание органических примесей наблюдается в природных водах в паводковые периоды.
ПОКАЖИ ТАБЛИЦУ стр 32.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 1017; Нарушение авторских прав?; Мы поможем в написании вашей работы!