
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Периодическая система элементов Д. И. Менделеева и изменение их свойств
|
|
|
|
Создание систематики химических элементов тесно связано с развитием представлений о строении атомов, о силах взаимодействия и природе связи их друг с другом, а также с данными о явлениях, характеризующих эти взаимодействия и связи. Современная систематика химических элементов создавалась в течение второй половины XIX и первой половины XX вв. на основе достижений химии и физики. К настоящему времени систематика химических элементов приобрела стройность и составила одну из основ современного естествознания благодаря трудам Дмитрия Ивановича Менделеева, открывшего периодический закон, Нильса Бора, связавшего теорию строения атомов с периодической систематикой, и Генри Мозли (1887-1915), давшего экспериментальную основу для бесспорного порядкового расположения химических элементов.
Открытие периодического закона. К середине XIX в. был накоплен достаточно богатый экспериментальный материал о свойствах химических элементов и их соединений. Так, было установлено, что оксиды щелочных и щелочноземельных металлов проявляют основные свойства, а оксиды галогенов и других неметаллических элементов – кислотообразующие свойства. Было известно также о существовании элементов с промежуточными свойствами, высшие оксиды которых являются кислотообразующими, а низшие – основными. Эти свойства химических элементов могли быть оценены тогда только качественно. Наряду с этим такие свойства химических элементов, как, например, атомные массы, валентность и некоторые другие, уже определяли количественно и весьма точно.
Еще в первой половине XIX в. стало ясно, что существуют не только различия между химическими элементами, но и сходство в свойствах, позволяющее группировать элементы в естественные семейства. Первые естественные семейства объединяли по три сходных элемента и получили название триад. Так, И. Доберейнер сгруппировал в такие триады: 1) литий, натрий и калий; 2) кальций, стронций и барий; 3) серу, селен и теллур; 4) хлор, бром и йод. При сравнении атомных масс элементов каждой триады Доберейнер установил, что атомная масса промежуточного по химическим свойствам члена каждой триады является средним арифметическим из атомных масс крайних ее членов.
|
|
|
Однако только Д. И. Менделееву удалось установить общий закон, охватывающий все стороны взаимосвязи между химическими элементами. В отличие от предшественников Д. И. Менделеев исходил из убеждения, что между всеми химическими элементами должна существовать закономерная объединяющая их взаимосвязь. В основу систематики элементов он положил их атомную массу. Располагая элементы в ряд по значениям их атомных масс и, сопоставляя при этом свойства элементов, он в отличие от предшественников рассматривал как раз свойства несходных элементов. Зная, что «атомные веса несходственных элементов никак не были сравниваемы между собой», Менделеев понял, что «как раз на несходственных элементах и обнаруживается закономерная зависимость свойств от изменений атомного веса».
Следует учесть, что, во-первых, во времена Менделеева было известно только 64 элемента (т. е. меньше двух третей от известных в настоящее время элементов), т. е. элементы не составляли полного ряда; во-вторых, не было уверенности в правильности определения атомных масс известных элементов. Менделеев расположил известные тогда(1869 г) химические элементы в ряд в порядке возрастания атомных масс, что дало возможность установить закономерности изменения их свойств. На этом основании он оставлял в этом ряду свободные места для еще неоткрытых элементов и исправлял в некоторых случаях неправильно вычисленные атомные массы элементов.
|
|
|
Сущность периодического закона. Исследуя изменения свойств химических элементов, расположенных в ряд по возрастающим значениям их атомной массы, Менделеев установил, что сходные в химическом отношении элементы встречаются через правильные промежутки (числа элементов) и, таким образом, одни и те же свойства периодически повторяются в этом ряду. На этом основании Менделеев и вывел периодический закон, или, как он его назвал, закон периодичности, который сформулировал первоначально следующим образом:
свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от величины атомных весов элементов.
Располагая все элементы в ряд, Менделеев, по существу, придал каждому элементу порядковый, или атомный, номер. То, что этот номер имеет более важное значение, чем атомная масса, подтверждалось тем фактом, что в менделеевском ряду элементов в трех местах нарушался принцип размещения элементов в поряде возрастания атомных масс. Несмотря на то что атомные массы аргона, кобальта и теллура больше, соответственно, чем калия, никеля и йода, Менделеев ставит аргон впереди калия, кобальт впереди никеля и теллур впереди йода. И хотя Менделеев полагал, что это нарушение объясняется недостаточно точным определением атомных масс указанных элементов, по существу он открыл более фундаментальную, чем атомная масса, величину, характеризующую химические элементы. Впоследствии выяснился физический смысл атомного (порядкового) номера элемента – он совпадает по числовому значению с положительным зарядом ядер атомов соответствующих элементов, а следовательно, и с числом электронов в этих атомах.
Таким образом, периодический закон установил то положение, что все свойства элементов и их соединений в конечном счете зависят от их атомного номера, т. е. от значения заряда ядер атомов. Атомные массы также являются функцией этого фундаментального числа.
Таблицы периодической системы. На основании открытого им периодического закона Менделеев составил периодическую систему элементов. Он разбил весь ряд элементов на отдельные отрезки, внутри которых начинается и заканчивается периодическое изменение свойств, и расположил эти отрезки один под другим. Как известно, таблица Менделеева в ее так называемой короткопериодной форме (таблица 2 на первом форзаце книги) подразделяется на семь горизонтальных периодов и восемь вертикальных групп.
|
|
|
Первый период включает всего два элемента, второй и третий периоды – по восемь, четвертый и пятый – по восемнадцать, шестой, седьмой – по тридцать два элемента. Первые три периода называются малыми, а четвертый и следующие – большими. Большие периоды подразделяются на ряды, малые же периоды совпадают с соответствующими рядами. В каждой группе элементы больших периодов подразделяются на две подгруппы – главную и побочную. Элементы малых периодов – второго и третьего – относятся кглавной подгруппе. Основанием для помещения элементов в ту или иную группу являлась максимально возможная валентность элемента – ее значению соответствует номер группы; исключение составляют кислород, фтор, неон и элементы побочной подгруппы VIII группы, валентность которых не достигает соответственно шести, семи и восьми, а также элементы побочной подгруппы I группы, валентность которых достигает трех. Номер каждого периода совпадает с числом электронных уровней в оболочках атомов, а номер группы – с числом электронов на наружном уровне электронной оболочки, хотя это выполняется только для атомов элементов главных подгрупп.
Кроме короткопериодной формы системы Менделеева часто пользуются длиннопериодной формой (таблица3 на втором форзаце книги) (впервые она была предложена также Менделеевым) и иногда — формой Томсена — Бора:
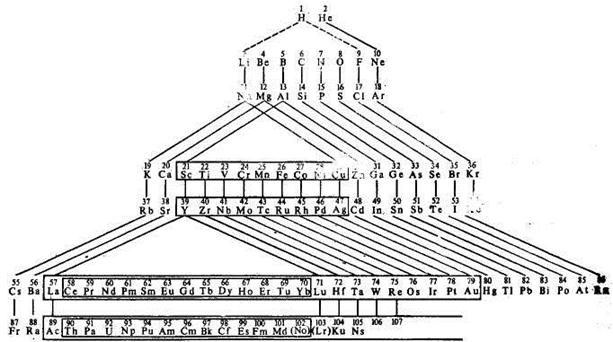
Длинная форма периодической системы подразделяется на семь рядов, которые совпадают с соответствующими периодами. В больших периодах длиннопериодной формы таблицы восемнадцать групп и элементы побочных подгрупп отделены от элементов главных подгрупп. Родство элементов побочных подгрупп с элементами соответствующих главных подгрупп в длиннопериодной форме устанавливается тем, что соответствующим подгруппам придаются одинаковые номера, только с разными индексами: главным – А, а побочным – В. Так обозначаются шестнадцать подгрупп, а подгруппы кобальта и никеля или оставляют вообще без номера, или присоединяют к подгруппе железа, придавая всем трем подгруппам номер VIIIB.
|
|
|
Ступенчатая форма таблицы Томсена – Бора отличается от длиннопериодной формы тем, что в ней элементы-аналоги не располагаются в одних и тех же вертикальных столбцах.
Экспериментальное обоснование периодической системы. Рассмотрение периодической системы показывает, что в группах и подгруппах располагаются электронные аналоги. Электронной аналогии соответствует аналогия и в химических свойствах элементов. Таким образом, при расположении химических элементов в ряд с увеличением атомного номера периодически повторяются электронные структуры атомов и химические свойства элементов. Очевидно, что атомный номер элемента и определяет электронную структуру его атома и связанные с нею его химические свойства. В этом заключается фундаментальное значение атомного номера элементов.
В развитии периодического закона большую роль сыграл открытый Г. Мозли закон, позволяющий экспериментально устанавливать значение атомного номера. Исследуя рентгеновские спектры различных элементов, Мозли установил простое соотношение между длиной волны рентгеновского излучения, испускаемого атомами, и атомным номером соответствующего элемента. Это соотношение, получившее название закона Мозли, сводится к следующему: атомный номер химического элемента связан линейной зависимостью с квадратным корнем величины, обратной длине волны рентгеновского излучения, испускаемого соответствующими атомами:

где а – постоянный для всех элементов коэффициент, Z – атомный номер элемента; λ– длина волны рентгеновского излучения. Отсюда следует, что, измерив длину волны излучения и зная коэффициент а, можно вычислить атомный номер элемента. Закон Мозли дал возможность установить, правильно ли расположил Менделеев элементы в периодической системе, а также определить общее число элементов в каждом периоде. Посредством анализа рентгеновских спектров в соответствии с законом Мозли были открыты неизвестные ранее элементы – гафний, рений и др.
Общенаучное значение периодического закона. Открытый Д. И. Менделеевым периодический закон дал возможность рассматривать химические элементы во взаимосвязи друг с другом, предсказывать свойства новых, ранее неизвестных элементов и их соединений. Менделеев указывал, что «до периодического закона элементы представляли лишь отрывочные, случайные явления природы; не было повода ждать каких-либо новых, а вновь находимые были полной неожиданной новинкой. Периодическая зависимость первая дала возможность видеть неоткрытые еще элементы в такой дали, до которой невооруженное этой закономерностью зрение до сих пор не достигло».
На основе периодического закона были исправлены значения атомных масс некоторых элементов, а также уточнено представление о валентности некоторых элементов.
Философское значение периодического закона заключается в том, что он подтвердил наиболее общие законы развития природы – законы единства и борьбы противоположностей, перехода количества в качество, отрицания отрицания. Ф. Энгельс так оценил философское значение периодического закона: «Менделеев, применив бессознательно гегелевский закон о переходе количества в качество, совершил научный подвиг».
Велико значение периодического закона в развитии естествознания и техники. На основе периодического закона плодотворно развивалось учение о строении атома. Оно, в свою очередь, вскрыло физический смысл периодической системы элементов и дало основу для понимания расположения элементов в ней.
Правильность учения о строении атомов всегда проверялась периодическим законом. Современная теория строения атомов
открывает пути к использованию запасов атомной энергии в веществе для нужд человечества. С уверенностью можно отметить, что периодический закон стимулировал все великие открытия физики и химии XX в. Периодический закон сыграл также выдающуюся роль в развитии смежных с химией естественных наук. Он еще во многом послужит человечеству при овладении тайнами природы.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 1249; Нарушение авторских прав?; Мы поможем в написании вашей работы!