
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы электролитов. Осмотическое давление, понижение давление пара, повышение температуры кипения и понижение температуры замерзания растворов кислот
|
|
|
|
Осмотическое давление, понижение давление пара, повышение температуры кипения и понижение температуры замерзания растворов кислот, щелочей и солей, относящихся к электролитам, имеют бóльшие значения по сравнению с величинами, которые характеризуют растворы неэлектролитов той же концентрации. Наблюдаемые отклонения были объяснены на основе теории электролитической диссоциации. Согласно этой теории, молекулы электролитов, в отличие от молекул неэлектролитов, при растворении распадаются на заряженные частицы – ионы. Например:
KOH ® K+ + OH-,
NaCl ® Na+ + Cl-.
Конечно, переход ионов в раствор сопровождается их гидратацией (в общем случае сольватацией):
NaCl + nH2O ® Na+(H2O)x + Cl-(H2O)n-x
Распад (диссоциация) молекул на ионы приводит к увеличению общего числа частиц, что оказывает определенное влияние на свойства растворов. Если сопоставить одни и те же характеристики растворов электролитов (осмотическое давление, понижение давления пара и т.д.), полученные опытным путем и рассчитанные на основе законов Рауля и Вант-Гоффа, то первые окажутся больше вторых в одну и ту же величину:
 (8.7)
(8.7)
Коэффициент i получил название изотонического коэффициента. Это поправочный коэффициент, при введении которого законы Рауля и Вант-Гоффа становятся применимы для растворов электролитов.
Очевидно, что для растворов электролитов i всегда больше единицы (i > 1). Согласно теории электролитической диссоциации С. Аррениуса, развитой позднее в трудах российских физико-химиков И.А. Каблукова, В.А. Кистяковского на основе гидратной теории растворения Д.И. Менделеева, физический смысл изотонического коэффициента i состоит в увеличении общего числа частиц в растворе за счет частичного или полного распада растворенного вещества на ионы. Здесь под частицами подразумевают как отдельные ионы, так и нераспавшиеся молекулы.
|
|
|
Степень диссоциации электролита в растворе является количественной характеристикой электролитической диссоциации (ионизации). Степень диссоциации a есть отношение числа молекул n, распавшихся на ионы, к общему числу растворенных молекул n0:
a =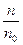
(a выражают в долях единицы или в процентах).
По степени диссоциации электролиты делят на сильные и слабые.
Сильные электролиты при растворении в воде полностью диссоциируют на ионы, степень диссоциации a» 1. К ним относятся: 1) почти все соли; 2) многие минеральные кислоты (H2SO4, HCl, HNO3 и т.д.); 3) основания щелочных и щелочно-земельных металлов.
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы. Степень диссоциации слабых электролитов a «1. В эту группу входят: 1) почти все органические кислоты; 2) некоторые минеральные кислоты (H2CO3, H2S, HNO2, H2SiO3 и т.д.); 3) многие основания металлов (кроме оснований щелочных и щелочно-земельных металлов, а также NH3·H2О). К слабым электролитам относят и воду.
По величине a разделить сильные и слабые электролиты затруднительно, так как степень диссоциации зависит от природы растворителя, температуры и концентрации раствора.
Электролитическую диссоциацию, как любой равновесный процесс, удобно характеризовать константой химического равновесия, которую в данном случае называют константой диссоциации. Так, для реакции
АВ ® А+ + В-
константа диссоциации К, согласно закону действующих масс, равна:

где [ A+ ], [ B- ], [ AB ] – молярные концентрации реагентов. Величина К зависит от свойств растворенного вещества: от прочности связи меду фрагментами молекул электролита, образующими катион и анион, от диэлектрических свойств растворителя, его способности сольватировать ионы, от температуры и давления, но не зависит от концентрации раствора. Следует отметить, что законы химического равновесия применимы только к слабым электролитам.
|
|
|
Для сильных электролитов степень диссоциации не отражает истинного количества молекул электролита, распавшихся на ионы. Опытным путем определяют так называемую кажущуюся степень диссоциации, которая всегда меньше истинной степени диссоциации.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 669; Нарушение авторских прав?; Мы поможем в написании вашей работы!