
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Порядок и молекулярность химических реакций
|
|
|
|
Показатели степени, в которых концентрации реагирующих веществ входят в кинетическое уравнение химической реакции называются порядком реакции по данному веществу. Общий порядок реакции равен сумме частных порядков реакции по реагирующим веществам.
n = nA + nB (1.7)
(1.7)
По величине порядка различают реакции нулевого, первого, второго и третьего порядков. Реакции более высоких порядков практически не встречаются.
На ряду с порядком химические реакции характеризуются молекулярностью.
Молекулярностью химической реакции называется минимальное число реагирующих частиц, необходимых для осуществления элементарного акта реакции. Так как молекулярность определяется только числом частиц
реагирующих веществ, то при этом не имеет значения число частиц, образующихся в результате протекания реакции. В зависимости от минимального числа реагирующих частиц различают:
1) мономолекулярные (одномолекулярные) реакции, в которых в результате одного элементарного акта претерпевает превращение только одна молекула
Н2 = 2Н (1.8)
2) бимолеекулярные (двумолекулярные) реакции, в которых в результате элементарного акта претерпевают превращение две молекулы одного вещества
2Н = Н2 (1.9)
или две молекулы различных веществ
СО2 + Н2 = СО + Н2О (1.10)
3) трёхмолекулярные реакции, в которых претерпевают превращение три
молекулы
3О2 = 2О3 (1.11)
или
2О2 + NO = 2NO3 (1.12)
Согласно кинетической теории, условием взаимодействия является одновременное столкновение реагирующих частиц. Поскольку вероятность
одновременного столкновения четырёх молекул и более молекул ничтожно мала, то реакции более высокой молекулярности маловероятны. Даже трёхмолекулярные реакции встречаются крайне редко.
|
|
|
Молекулярность реакции является теоретическим понятием, которое характеризует механизм протекания реакции.
Таким образом, порядок реакции характеризует формальную зависимость
скорости химической реакции от концентрации реагирующих веществ, а молекулярность механизм её протекания. Если стехиометрическое уравнение
правильно отражает истинный механизм протекания реакции, то в этом случае молекулярность и порядок реакции совпадают. В общем случае такого совпадения не наблюдается. Поэтому стехиометрические коэффициенты в уравнении. Поэтому стехиометрические коэффициенты в уравнении химической реакции не всегда определяют её порядок.
 |
где –скорость реакции при температуре t2,
– скорость реакции при температуре t1,
– температурный коэффициент.
Задача: Определите, как изменится скорость некоторой реакции:
а) при повышении температуры от 10° до 50° С;
б) при понижении температуры от 10° – 0° С.
Температурный коэффициент реакции равен 3.
а) подставить данные задачи в формулу:
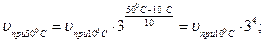 | ||
 |
скорость реакции увеличится в 81 раз.
 б)
б)
Скорость реакции уменьшится в 3 раза.
vt2 t2-t1/10
----- = (γ)
vt1
где γ – температурный коэффициент скорости реакции, показывающий, во сколько раз возрастает скорость на каждые 10 градусов.
Время протекания реакции имеет обратную зависимость от температуры:
τ t1 t2-t1/10
----- = (γ)
τ t2
Задача: Как изменится скорость реакции, имеющей кинетическое уравнение
|
|
|
v= kC(A) 2C(B), если
А) концентрацию вещества А увеличить в 3 раза;
Б) концентрацию вещества А увеличить в 3 раза, а концентрацию В уменьшить в 3 раза?
o Решение. Подставим соответствующие данные в кинетическое уравнение, сравним скорости реакций.
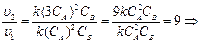 |
а)
скорость реакции увеличится в 9 раз.
 б)
б)
скорость реакции увеличится в 8 раз.
Для большинства химических реакций зависимость константы (скорости)
химической реакции от температуры выражается эмпирическим уравнением
Аррениуса:
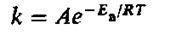 (1.54)
(1.54)
где Е – энергия активации химической реакции.
A – предэкспоненциальный коэффициент
В дифференциальной форме уравнение Аррениуса имеет вид:
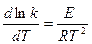 (1.55)
(1.55)
Условием протекания химической реакции является столкновение молекул реагирующих веществ. Однако в химическое взаимодействие вступают только те молекулы, которые обладают повышенным запасом энергии по сравнению со средней энергией частиц. Этот избыток энергии частица приобретает в результате хаотических столкновений с другими молекулами. Из этого следует, что под энергией активации понимают избыток энергии по сравнению со средним значением энергии реагирующих частиц, которым должна обладать реагирующая частица, чтобы вступить в химическое взаимодействие. Эта избыточная энергия необходима для преодоления энергетического барьера реакции. По современным представлениям она необходима для преодоления энергии отталкивания электронных облаков сталкивающихся молекул. Поэтому под энергией активации часто понимают энергетический барьер, который должны преодолеть реагирующие частицы, чтобы превратиться в продукты реакции.
Разность между энергиями прямой и обратной реакции представляет собой тепловой эффект химической реакции (Рисунок).
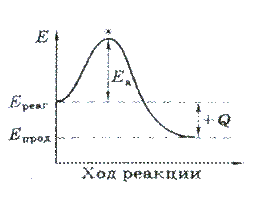
Е1- энергия активации прямой химической реакции;
Е2 – энергия активации обратной химической реакции;
ΔН – тепловой эффект химической реакции.
Из рисунка 4.1 видно, чтобы произошла химическая реакция, молекулы исходных веществ должны преодолеть энергетический барьер, равный Е1, т.е. обладать энергией активации, равной Е1.
Неопределённое интегрирование уравнения (4.29) при условии, что Е не зависит от температуры, даёт:
|
|
|
lnk = - 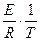 + C, (1.56)
+ C, (1.56)
где С – постоянная интегрирования.
Графически уравнение (1.56) имеет вид:
Рисунок. Зависимость lnk от 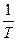
Измерив константу скорости химической реакции от температуры, можно
рассчитать энергию активации химической реакции:
Е = Rtgβ (1.57)
Определённое интегрирование уравнения (4.29) в пределах температур
Т1-Т2 даёт:
ln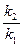 =
= 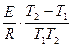 , (1.58)
, (1.58)
где k1 – константа скорости химической реакции при температуре Т1;
k2 - константа скорости химической реакции при температуре Т2.
Уравнение (4.32) позволяет рассчитать энергию активации химической реакции по двум значениям константы скорости химической реакции при различных температурах.
С увеличением энергии активации скорость химической реакции уменьшается и наоборот.