
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кривые титрования
|
|
|
|
В процессе титрования изменяются равновесные концентрации определяемого вещества, титранта и продуктов реакции. При этом пропорционально концентрациям этих веществ изменяются свойства раствора. Например, при окислительно-восстановительном титровании изменяются равновесные концентрации окислителя и восстановителя и, следовательно, потенциал; при изменении концентраций компонентов кислотно-основной реакции изменяется рН раствора.
График зависимости параметра системы, связанного с концентрацией титруемого вещества, титранта или продукта, от состава раствора в процессе титрования называют кривой титрования.
Кривые титрования помогают выбрать индикатор, оценить погрешность, наглядно проследить за ходом титрования.
При построении кривых по осям координат можно откладывать разные величины. Если по оси ординат отложить логарифм концентрации (или отношения концентраций) или величину, пропорциональную этому логарифму, получаются логарифмические кривые титрования.
Если же по оси ординат откладывать концентрацию или физико-химический параметр, пропорциональный концентрации, получаются линейные кривые титрования.
По оси абсцисс обычно откладывают объем добавленного титранта V т или степень оттитрованности f, т. е. отношение количества оттитрованного в данный момент вещества п т к исходному количеству n 0. Поскольку с т V т = п т и n 0 = с 0 V 0 = с т V тэ, получаем
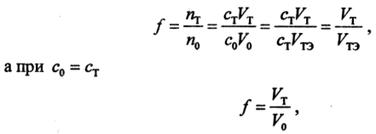
где V т – объем титранта, добавленный к данному моменту титрования; V 0 – исходный объем титруемого вещества; V тэ – объем титранта, добавленный к моменту эквивалентности; с 0 и с т – молярные концентрации эквивалентов (или нормальные концентрации) титруемого вещества и титранта.
|
|
|
Степень оттитрованности иногда выражается в процентах. До т.э. f < 1 (< 100%), за т.э. f > 1 (> 100%), в т.э. f = 1 (100%).
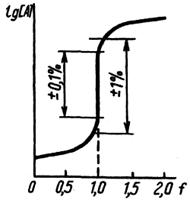
В некоторых случаях продукты реакции титрования практически не влияют на равновесные концентрации [А] или [Т]. Например, при титровании сильной кислоты сильным основанием, при осадительном титровании, при комплексонометрическом титровании продукты (Н2О, малорастворимое соединение или комплекс) практически выводятся из реакции. В этих случаях при построении кривых титрования по оси ординат можно отложить логарифм концентрации А (или Т). Такие кривые называют монологарифмическими.
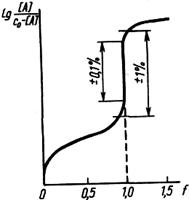
Если же продукты реакции каким-то образом влияют на [А] или [Т], то при расчете [А] следует учитывать равновесные концентрации продуктов. Например, при титровании слабых кислот (или оснований) и окислительно-восстановительном титровании получаются сопряженные вещества: при титровании слабой кислоты – сопряженное основание, при титровании окислителя – его восстановленная форма. Переменный параметр (рН или Е) будет определяться отношением концентраций сопряженной пары. Кривые, по оси ординат которых отложен логарифм отношения концентраций (или пропорциональная ему величина), называют часто билогарифмическими.
| 
|
| Монологарифмическая кривая титрования | Билогарифмическая кривая титрования |
Логарифмические кривые имеют S-образную форму. На кривых имеются области плавного (до и после ТЭ) и резкого (вблизи ТЭ) изменения рассчитываемого (или измеряемого) параметра. Область резкого изменения называют скачком титрования. Границы скачка устанавливаются в зависимости от заданной точности титрования. Чем выше требования к точности определения, тем уже скачок титрования. На величину скачка влияет ряд факторов: константа равновесия реакции, концентрация веществ, температура, ионная сила и др.
|
|
|
Кривую титрования можно охарактеризовать крутизной, которая является мерой чувствительности и точности титрования. Чем больше значение индекса крутизны, тем чувствительнее метод.
Для фиксирования конца титрования используют визуальные и инструментальные методы. К инструментальным методам относятся: потенциометрическое, амперометрическое, фотометрическое титрование.
При визуальном обнаружении ТЭ пользуются индикаторами (от лат. Indicare – показывать, обнаруживать). Это вещества, окраска которых изменяется при определенном значении параметра.
В первых титриметрических определениях (1729) в качестве основания использовали карбонат калия (поташ) и точку эквивалентности устанавливали по прекращению выделения газа. Впоследствии в методе кислотно-основного титрования наиболее широкое распространение получили цветные индикаторы, окраска которых зависела от рН раствора. Первое титрование с применением цветного индикатора выполнил У. Льюис в 1767 г, и первым индикатором, использованным для этой цели, был лакмус, хотя индикаторные свойства различных растительных экстрактов были известны значительно раньше.
В конце XIX века в практике титриметрического анализа стали применять синтетические индикаторы: сначала фенолфталеин, а затем азокрасители и другие соединения. В отличие от природных индикаторов они обладают достаточной химической устойчивостью, постоянством и воспроизводимостью их цвета при изменении рН раствора. Использование синтетических индикаторов позволило существенно повысить точность титриметрических методов анализа. Из растительных экстрактов до настоящего времени сохранили определенное значение лишь лакмус и куркума, применяемые главным образом для качественных испытаний.
Цветные индикаторы в кислотно-основном титровании – это слабые органические кислоты и основания, протонированные и непротонированные формы которых различаются по структуре и окраске. Они частично диссоциируют по схеме:
HInd = H+ + Ind-,
где HInd – недиссоциированная молекула индикатора; Ind- – анион индикатора.
По теории ионных окрасок Оствальда недиссоциированные молекулы индикатора HInd и аниона Ind- имеют разную окраску. Изменение цвета индикатора при изменении рН эта теория связывает со сдвигом равновесия диссоциации. С увеличением концентрации ионов водорода равновесие сдвигается влево и раствор приобретает окраску HInd, при уменьшении кислотности возрастает концентрация Ind- и окраска раствора изменяется.
|
|
|
Существуют одноцветные (например, фенолфталеин), у которых одна из форм индикатора (HInd или Ind-) бесцветна, и двухцветные (например, метиловый оранжевый) индикаторы, у которых окрашены обе формы.
К индикаторам предъявляют ряд требований:
1. Индикатор должен обладать высоким светопоглощением так, чтобы окраска даже его небольшого количества была заметна для глаза. Большая концентрация индикатора может привести к расходу на него титранта.
2. Переход окраски должен быть контрастным.
3. Область перехода окраски должна быть как можно у же.
Интервал рН, в котором индикатор изменяет свою окраску, называют интервалом перехода индикатора.
Середина области перехода окраски индикатора называется показателем индикатора и фактически отождествляется с конечной точкой титрования.
Для сужения области перехода окраски и увеличения контрастности применяют смешанные индикаторы, которые составляют из индикатора и красителя. При определенном значении рН цвет красителя является дополнительным к цвету индикатора – в результате в этой точке окраска будет серой, а переход от окрашенного раствора к серому – контрастным.
На область перехода окраски индикатора (положение и интервал) влияют все факторы, от которых зависит константа равновесия: ионная сила, температура, посторонние вещества, растворитель, а также концентрация индикатора.
Ионная сила по-разному влияет на индикаторы разных групп в зависимости от того, заряженной или незаряженной является кислотная или щелочная форма.
Интервал перехода индикатора смещается при нагревании.
Из посторонних веществ следует отметить влияние углекислого газа, который уменьшает рН водного раствора, а также высокомолекулярных веществ, которые приводят к взаимодействию кислотных и основных групп белков и индикаторов и адсорбции индикаторов на поверхности коллоидных частиц (белковая ошибка титрования).
|
|
|
Индикатор выбирают так, чтобы его окраска изменялась в пределах установленного скачка титрования (не обязательно в ТЭ). При этом точка изменения окраски индикатора (конечная точка титрования, КТТ) не совпадает с ТЭ, что вызывает погрешность титрования (положительную, если титрование заканчивается после достижения ТЭ, и отрицательную, если раньше). Для правильного выбора индикатора и оценки погрешности титрования необходимо построение кривой титрования.
В принципе для выбора индикатора нет необходимости строить всю кривую: достаточно рассчитать значение параметра на границах заданного скачка, исходя из требуемой точности определения.
Линейные кривые строят, откладывая по оси ординат свойство системы, прямо пропорциональное концентрации определяемого вещества, титранта, продукта реакции или их комбинации. Таким свойством может быть электродный потенциал, светопоглощение, электрическая проводимость и т.д.
Примеры возможных типов линейных кривых титрования:
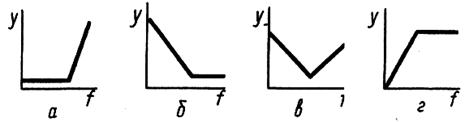
у – свойство, f – степень оттитрованности
а — сигнал обусловлен титрантом; б — сигнал обусловлен титруемым веществом; в — сигнал обусловлен и титруемым веществом и титрантом; г — сигнал обусловлен продуктом взаимодействия титранта и титруемого вещества
Кривые состоят из 2 прямолинейных отрезков, пересекающихся в ТЭ. Резкий перегиб в ТЭ наблюдается, если константа равновесия реакции достаточно велика (k >> 103). В противном случае вблизи ТЭ происходит искривление прямолинейных участков. В этом случае ТЭ находят экстраполяцией (графической или расчетной) линейных участков, достаточно удаленных от ТЭ, когда реакция практически смещена влево или вправо. Достоинством линейных кривых является простота построения: в благоприятных случаях кривую можно построить по 4 результатам измерения (двум – при f < 1 и двум – при f > 1).
Линейные кривые обычно получают экспериментально при фотометрическом, кондуктометрическом, термометрическом и радиометрическом титровании.
|
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 10363; Нарушение авторских прав?; Мы поможем в написании вашей работы!