
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Расчет результата в методе обратного тирования
|
|
|
|
Рассмотрим расчет результата на примере обратного титрования хлорида. В этом методе к анализируемому раствору хлорида добавляется заведомый избыток титрованного раствора AgNО3 и не вступившее в реакцию с хлоридом количество вещества AgNO3 оттитровывается раствором NH4SCN. Если n (AgNO3) – количество вещества AgNO3, добавленное к анализируемому раствору хлорида, n (AgCl) – количество вещества эквивалента AgNO3, израсходованное на реакцию с хлоридом, a n (AgSCN) – на реакцию с тиоцианатом, то:
n (AgNO3) = n (AgCl) + n (AgSCN) (9)
Величина n (AgNO3) определяется молярной концентрацией эквивалента основного рабочего раствора AgNO3 и его объемом:
 (10)
(10)
Молярная концентрация эквивалента раствора NH4SCN и его объем, затраченный на реакцию с избытком AgNO3 после осаждения хлорида, точно известны, поэтому
 (11)
(11)
Количество вещества эквивалента хлорида в анализируемом растворе находим из уравнения (9):
n (AgCl) = n (AgNO3) – n (AgSCN)
и подставляем в это соотношение уравнения (10) и (11):

Результат обратного титрования всегда рассчитывается по разности между взятым количеством вещества эквивалента основного рабочего вещества и оставшимся после его реакции с определяемым компонентом.
Погрешность методов обратного титрования можно рассчитать также с помощью формулы (7). Причем для упрощения ориентировочных расчетов примем, что концентрация обоих рабочих растворов одинакова. Тогда последнее уравнение переходит в:
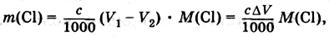 (12)
(12)
где с = c (AgN03) = c (NH4SCN), a Δ V = V1 – V2, если V1 = V (AgNО3), a V2 = V (NH4SCN).
Применим к уравнению (12) формулу (7):
 (13)
(13)
Погрешность определения молярной концентрации эквивалента Sc в уравнении (13) будет зависеть от погрешностей, с которыми определены концентрации каждого из растворов, и по закону сложения ошибок будет равна:
|
|
|
 (14)
(14)
где S1 и S2 – погрешности определения молярной концентрации эквивалента растворов AgNО3 и NH4SCN соответственно.
Погрешность разности объемов SΔV вычисляют с помощью формулы:
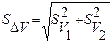 (15)
(15)
где SV1 и SV2 – погрешности определения объемов AgNО3 и NH4SCN соответственно.
При подстановке уравнений (14) и (15) в (13) получаем:
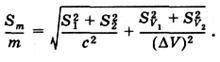 (16)
(16)
Если считать, что при работе с 0,1 М растворами погрешности в определении молярной концентрации эквивалента составляют ±0,0002, а объемы рабочих растворов определяются с погрешностью ±0,02 мл, подстановка числовых значений в уравнение (16) дает:
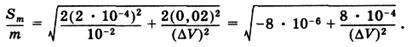 (17)
(17)
Из уравнения (17) видно, что погрешность анализа в значительной степени зависит от разности объемов рабочих растворов, использованных при титровании: с увеличением разности погрешность уменьшается. Расчет по уравнению (17) показал, что при Δ V = 1,0 мл относительная погрешность анализа составляет 2,8%, при Δ V = 5,0 мл она уменьшается до 0,63%, а при Δ V = = 25,0 мл до 0,32%. Очевидно, при обратном титровании разность объемов 0,1 н. рабочих растворов менее 10,0 мл нежелательна в связи с большой погрешностью анализа. Приведенные расчеты носят ориентировочный характер, т.к. связаны с некоторыми допущениями и заключительная рекомендация о предельной величине Δ V = 10,0 мл абсолютного значения не имеет, но окончательный вывод об увеличении погрешности анализа с уменьшением разности объемов рабочих растворов останется справедливым в любом случае.
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 617; Нарушение авторских прав?; Мы поможем в написании вашей работы!