
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физико-химические процессы, используемые в процессах очистки газовых потоков, основные понятия
Нормы удельных выбросов СО, СН и NОх
| Удельные выбросы | Норма, г/(кВтч) |
| Оксид углерода, не более | 9,5 |
| Углеводороды, не более | 3,4 |
| Оксиды азота, не более | 18,35 |
Контроль дымности ОГ при стендовых испытаниях дизелей. Дымность ОГ измеряют у дизелей, прошедших предварительные. Приемочные и периодические испытания. По ГОСТ 17.2.2.01-84 дымность (оптическая плотность) ОГ при стендовых испытаниях дизелей измеряют на режимах внешней скоростной характеристики и на режиме свободного ускорения.
На каждом режиме внешней скоростной характеристики дымность измеряют 3 раза, при этом разность результатовизмерений не должна превышать 4 %.За результат измерений принимают среднее арифметическое значение трех измерений.
Дымность на режиме свободно ускорения измеряют по возможности сразу после измерений по скоростной характеристике, при этом дизель должен быть отсоединен от тормоза.
От минимальной частоты вращения холостого хода быстрым, но плавным перемещением до упора рычага управления устанавливают максимальную подачу топливного насоса. Такое положение рычага сохраняется до достижения максимальной частоты вращения, ограничиваемой регулятором. При этом по шкале измерительного прибора фиксируют максимальное значение дымности. Дымность на режиме свободного ускорения измеряют восемь раз. За результат измерения принимают среднее арифметическое четырех последних измерений, разность между которыми не должна превышать 4%.
Дымность ОГ автомобильных дизелей при испытании на установившихся режимах не должна превышать предельно допустимые нормы.
Дымность на режиме свободного ускорения не должна превышать максимальную дымность, измеренную при испытаниях данного дизеля на установившихся режимах внешней скоростной характеристики. Для дизелей с газотурбинным наддувом дымность на режиме свободного ускорения не должна превышать более чем на 10% максимальную дымность, измеренную не внешней скоростной характеристике.
При реализации ЖЦ транспортных объектов, наряду с изложенными, возникают или используются и другие физико-химические процессы взаимодействия с окружающей средой. В их числе процессы: разделения неоднородных систем (инерционного, гравитационного, диффузионного, электростатического осаждения аэрозолей на препятствиях); абсорбции и ионного обмена; перегонки жидкостей; жидкостной экстракции; растворения и экстрагирования в системе твердое тело – жидкость; кристаллизации; сушки; массообмена через мембраны; нейтрализации и др.[9].
Неоднородные (гетерогенные) системы — это системы, состоящие как минимум из двух фаз. При этом одна из фаз является сплошной, а другая — дисперсной, распределенной в первой в раздробленном состоянии в виде капель, пузырей, мелких твердых частиц и т. д. В зависимости от физического состояния фаз различают суспензии, эмульсии, пыли, дымы и туманы.
Суспензия состоит из жидкости и взвешенных в ней твердых частиц. Суспензии условно подразделяются на грубые (с частицами размером более 100 мкм), тонкие (содержащие частицы размером 0, 1—100 мкм) и коллоидные растворы (с частицами менее 0,1 мкм).
Эмульсия состоит из жидкости и распределенных в ней капель другой жидкости, не растворяющейся в первой, а пена — из жидкости и распределенных в ней пузырьков газа.
Дым и пыль состоят из газа и распределенных в нем твердых частиц размером соответственно до и более 5 мкм. Туман состоит из газа и распределенных в нем капель жидкости размером менее 5 мкм. Пыли, дымы и туманы являются аэродисперсными системами и называются аэрозолями. Процессы, связанные с разделением неоднородных систем, играют большую роль при подготовке сырья и очистке готовых продуктов, при очистке сточных вод и отходящих газов, а также при выделении из них ценных компонентов. Применяют следующие методы разделения: осаждение, фильтрование и мокрую или сухую очистку газов.
Осаждение — процесс разделения, при котором взвешенные в жидкости или газе твердые или жидкие частицы отделяются от сплошной фазы под действием сил тяжести (отстаивание), центробежкой силы (циклонный
процесс и центрифугирование), сил инерции, электростатических сил (очистка газов в электрическом поле).
Фильтрование — процесс разделения с помощью пористой перегородки, способной пропускать жидкость или газ, но задерживать
взвешенные частицы движущей силой процесса фильтрования является разность давлений. В случаях, когда разность давлений создается центробежными силами, процесс называют центробежным фильтрованием.
Мокрая или сухая очистка газов — процесс разделения, основанный на улавливании (осаждении) взвешенных в газе частиц жидкостью или твердым (пористым) материалом (ткань, решетка и др.). Улавливание осуществляется, как правило, под действием сил инерции, гравитации, диффузии, электростатического осаждения аэрозолей на препятствиях, вносимых в газовый поток.
Эффективность пылеулавливания характеризуется общим и фракционным показателями степени очистки воздуха от пыли. Общий показатель эффективности пылеулавливания характеризует этот процесс без учета крупности улавливаемой пыли:
η0=m2/m1, (22)
где m2— масса осажденной пыли; m1— масса пыли, находящейся в воздушном потоке на входе.
Фракционный показатель эффективности пылеулавливания характеризует процесс улавливания пыли заданной крупности:
ηф= [αп-βп(1-η0)ηα]/αп, (23)
где αп — содержание пыли заданной крупности в воздухе до очистки, %; βп — содержание пыли той же крупности в воздухе после очистки, %.
Увеличению размеров частиц в аэрозоле с целью их дальнейшего улавливания могут способствовать процессы коагуляции (слипания, сливания) под действием броуновского движения, гравитационных, электрических, гидродинамических, магнитных сил.
Абсорбция - процесс поглощения газов или паров из газовых или парогазовых смесей жидким поглотителем — абсорбентом. Д ля абсорбции газа используют жидкие растворители (воду с добавками химических веществ), которые реагируют с вредными веществами в газовом потоке при разных способах контакта между газовой и жидкой фазами. Газы, растворимость которых при 273 К и парциальном давлении 101 кНа составляют сотни граммов на 1 кг воды, — хорошо растворимые (НСl, НF, NН3). Если растворяются доли грамма вещества, то их называют плохо растворимыми ( 02, N 2, СО).
Если поглощаемый газ — абсорбтив — химически не взаимодействует с абсорбентом, это физическая абсорбция. Если же абсорбтив образует с абсорбентом химическое соединение, то такой процесс называют хемосорбцией. В технических устройствах распространено сочетание обоих видов абсорбции.
Физическая абсорбция (или просто абсорбция) обычно обратима. На этом свойстве абсорбционных процессов основано выделение поглощенного газа из раствора — десорбция. Десорбцию газа проводят отгонкойего в токе инертного газа или водяногопара в условиях подогрева абсорбента или снижения давления над абсорбентом. Отработанные после хемосорбции абсорбенты обычно регенерируют химическими методами или нагреванием. Сочетание абсорбции и десорбции позволяет многократно применять поглотитель и выделять поглощенный газ в чистом виде.
В транспортном комплексе процесс абсорбции применяют для нейтрализации газовых примесей НСl, НF, NН3, SО2, Сl2, Н2S. Добавки химических реагентов используются для увеличения движущей силы массопереноса и изменения молекулярных формул абсорбируемого загрязнителя. Так, при очистке газа от S02 в абсорбере с водным раствором NаОН и происходят реакции
SO2+2NaOH – Na2SO3+H2O
Na2SO3+Ca(OH)2 – CaSO4+2NaOH
Абсорберы получили распространение и на автомобилях, работающих в замкнутых пространствах (теплицах, под землей, карьерах), для очистки отработавших газов от токсичных веществ.
Адсорбция — процесс поглощения вещества из смеси газов, паров или растворов поверхностью или объемом пор твердого тела — адсорбента. Поглощаемое вещество, находящееся в объемной фазе (газе, паре или жидкости), называется адсорбтивом, а поглощенное — адсорбатом. Адсорбцию подразделяют на физическую и химическую. Физическая адсорбция обусловлена поверхностными силами, которые проявляются на расстояниях, значительно превышающих размеры адсорбируемых молекул. Поэтому на поверхности адсорбента обычно удерживаются несколько слоев молекул адсорбата. При химической адсорбции поглощаемое вещество вступает в химическое взаимодействие с адсорбентом с образованием на его поверхности обычных химических соединений.
Силы притяжения возникают на поверхности адсорбента из-за того, что силовое поле поверхностных атомов и молекул не уравновешено силами взаимодействия соседних частиц. По физической природе силы взаимодействия молекул поглощаемого вещества и адсорбента относятся к дисперсионным, возникающим благодаря перемещению электронов в сближающихся молекулах. При этом большое значение имеют электростатические и индукционные силы, а также водородные связи.
Заполнение адсорбатом поверхности адсорбента частично уравновешивает поверхностные силы и вследствие этого снижает поверхностное натяжение (свободную удельную поверхностную энергию). Поэтому адсорбция является самопроизвольным процессом, течение которого сопровождается уменьшением свободной энергии и энтропии системы, а также энтальпии, что равнозначно выделению теплоты, т. е. процессы адсорбции экзотермичны. Они также избирательны и обратимы. Процесс, обратный адсорбции, называют десорбцией, которую используют для выделения поглощенных веществ и регенерация адсорбента.
Адсорбцию применяют для обработки смесей с низкой концентрацией извлекаемых веществ. Типичные примеры — осушка газов и жидкостей, разделение смесей углеводородов, рекуперация растворителей, очистка вентиляционных выбросов и сточных вод.
Ионный обмен — частный случай хемосорбции. Происходит между твердым ионообменным сорбентом (ионитом) и раствором электролита. Кинетика, а также аппаратурное оформление ионообменных процессов близки к адсорбционным.
В промышленности используют природные ионообменные сорбенты (цеолиты, бентонитовьие глины, фосфат титана, циркония и др.), так и синтетические (ионообменные полимеры, смолы). Синтетические сорбенты-иониты представляют полимерную матрицу с трехмерной структурой макромолекул, имеющую ионогенные группы. В растворе иониты образуют неподвижные макромолекулярные ионы и подвижные ноны противоположного знака. В зависимости от типа подвижного иона иониты делят на катиониты, — поликислоты, способные обмениваться с раствором катионами, и аниониты — полиоснования, обменивающиеся с раствором анионами.
Ионный обмен применяют при производстве неорганических веществ, в энергетике (глубокая очистка воды перед подачей ее в котлы), при очистке сточных вод. Недостаток — частая регенерация ионитов с последующей их промывкой, что связано с дополнительным расходом реагентов (обычно кислот и щелочей) и образованием значительного объема сточных вод.
Кроме рассмотренных выше методов для очистки сточных вод, а также в оборотных системах водоснабжения на транспортных предприятиях применяют методы флотации, гиперфильтрации, эвапорации, выпарачивания, испарения и кристаллизации, нейтрализации, электрохимической очистки и др.
Ф л о т а ц и я — заключается в обволакивании частиц масло - продуктов пузырьками воздуха, подаваемого в сточную воду, и предназначена для интенсификации процесса их всплывания. В основе процесса — молекулярное слипание частиц масла и пузырьков тонкодиспергированного в воде воздуха. Образование агрегатов «частица - пузырьки воздуха» зависит от их столкновения друг с другом и т. д.
В зависимости от способа образования пузырьков воздуха различают следующие виды флотации: напорную, пневматическую, химическую, вибрационную, биологическую, электрофлотацию.
Последняя широко применяется в промышленности, так как электрохимические процессы обеспечивают дополнительное обеззараживание сточных вод. Образование газовой фазы при электролизе сточных вод сопровождается выделением Н2, О2, N2, Сl2.
Объем и площадь сечения флотационной камеры, объемную плотность тока рассчитывают исходя из расходов газа и сточной воды, степени газонаполнения сточной воды, площади поверхности пенообразования.
П е р е г о н к а ж и д к о с т е й — процесс, в котором разделяемая жидкая смесь нагревается до кипения, а образующийся пар отбирается и конденсируется. В результате получают жидкость-конденсат, состав которой отличается от состава начальной смеси. Повторяя много раз процессы испарения и конденсации, можно разделить исходную смесь на чистые составные части (компоненты).
Процесс перегонки основан на том, что составляющие смесь жидкости обладают различным давлением (упругостью) пара при одной и той же температуре. Поэтому состав пара, а, следовательно, и состав жидкости, получающейся при конденсации пара, будут отличаться от состава начальной смеси: легколетучего (или низкокипящего) компонента в паре будет содержаться больше, чем в перегоняемой жидкости. В неиспарившейся жидкости концентрация труднолетучего (или высококипящего) компонента при этом должна увеличиться. В простейшем случае перегонка не отличается от выпарки. Но выпарке подвергаются растворы, состоящие из летучего растворителя и практически нелетучего растворенного вещества, а при перегонке в пар переходят как растворитель, так и растворенное вещество.
Перегонка — важный технологический процесс разделения и очистки жидкостей и сжиженных газов в химической, нефтехимической и других отраслях промышленности; разделяется на простую перегонку (или дистилляцию) и ректификацию. На транспортных предприятиях этот процесс используется для получения дистиллированной воды, необходимой для приготовления электролита аккумуляторных батарей.
Простая перегонка — процесс однократного частичного испарения исходной жидкой смеси и конденсации образующихся при этом паров. Ее применяют для разделения смесей, представляющих собой легколетучее вещество с некоторым содержанием труднолетучих веществ (предварительное разделение, очистка веществ от примесей, смол, загрязнений). При этом сконденсированные пары называют дистиллятом, а оставшуюся неиспаренной жидкость — остатком.
Ректификация — разделение смесей жидкостей, целиком или частично растворенных друг в друге. Процесс заключается в много кратном взаимодействии паров с жидкостью — флегмой, полученной при частичной конденсации паров.
Жидкостная экстракция — процесс перехода одного или нескольких растворенных веществ из одной жидкой фазы в другую при их непосредственном контакте, практически нерастворимую или частично растворимую в первой, но растворяющую эти вещества. Экстракцию из твердых веществ жидкостью (растворителем) называют экстрагированием. Если в этом процессе в качестве, растворителя используется вода, то такую экстракцию называют выщелачиванием.
Процессы жидкостной экстракции применяют в химической, нефтехимической, металлургической промышленности с целью извлечения ценных или токсичных веществ из растворов, в том числе и из сточных вод предприятий, а также для получения концентрированных растворов этих веществ.
Процесс экстракции экономически выгоднее, например, ректификации, когда концентрация извлекаемого компонента мала, так как при экстракции не нужно испарять всю жидкую смесь. Экстракцию целесообразно применять также, если смесь невозможно и трудно разделить ректификацией или разделяемая смесь разлагается при нагревании. Обычно жидкостную экстракцию сочетают с ректификацией, которую применяют для регенерации экстрагирующей жидкости, называемой экстрагентом или растворителем. Кроме ректификации для регенерации экстрагента применяют такие метод как нагревание, выпаривание и др. Раствор извлеченных веществ в экстрагенте называют экстрактом, а раствор, из которого удалены экстрагируемые компоненты, — рафинатом.
Процесс экстракции всегда связан с добавлением к разделяемому раствору экстрагента, что неизбежно приводит к загрязнению продуктов разделения и к необходимости последующей очистки естественно, к удорожанию процесса. Этот недостаток экстракционныхпроцессов существенно ограничивает области ихприменения.
Р а с т в о р е н и е — переход вещества в раствор с поверхности частиц. Производится с целью разделения системы, состоящей из растворимых и инертных частиц, когда растворимые частицы отделе от инертных, а последние не оказывают существенного влияния ни на кинетику растворения, ни на конечные результаты процесса.
При физическом растворении исходное твердое вещество может быть вновь получено кристаллизацией из раствора. Химическое растворение — гетерогенная химическая реакция, продукты которой растворяются в жидком объеме. Возврат к исходному твердому веществу путем кристаллизации здесь невозможен. При химическом растворении могут образовываться твердые или газообразные продукты реакции, значительно осложняющие кинетику растворения.
Процессы растворения протекают достаточно быстро, чему способствует непосредственный контакт движущейся (перемешиваемой) жидкости с поверхностью растворяющихся частиц.
Э к с т р а г и р о в а н и е — процесс извлечения одного или нескольких компонентов из твердого материала путем избирательного растворения в жидкостях (экстрагектах). Извлекаемые компоненты содержатся в порах твердого тела в виде растворенного вещества или в виде твердой фазы. В первом случае говорят об экстрагировании растворенного вещества, во втором — об экстрагировании твердого вещества.
Процесс экстрагирования растворенного вещества состоит в следующем. Растворенное вещество, содержащееся в пористой структуре твердого тела, диффундирует в основную массу жидкости; концентрация целевого компонента в порах неуклонно снижается, а жидкости (экстрагенте) увеличивается. Механизм экстрагирования твердого вещества отличается большей сложностью и включает себя три стадии:
1) проникание экстрагента в пористую структуру твердого тела;
2) растворение целевого компонента в экстрагенте;
3) диффузия растворенного компонента в основную массу жидкости.
Скорость процесса в целом лимитируется третьей стадией, как наиболее медленной.
Экстрагирование твердого вещества кинетически неравноценно его растворению. В условиях растворения вещество непосредственно контактирует с движущейся жидкостью, благодаря чему сопротивление массопереносу невелико. В условиях экстрагирования твердого вещества область, содержащая целевой компонент, первоначально занимает весь объем частицы, а с ходом экстрагирования систематически сокращается. Извлекаемый компонент только в первый момент экстрагирования находится в контакте с движущейся жидкостью, а впоследствии теряет контакт с нею. Перенос веществ к границам пористого тела происходит с помощью механизма молекулярной диффузии в неподвижной жидкости, заполняющей пористый объем. По этой причине экстрагирование — менее интенсивный процесс по сравнению с растворением.
Средством интенсификации упомянутых процессов является уменьшение размеров частиц, поступающих на растворение или экстрагирование. Но с уменьшением размера частиц возрастает мощность, расходуемая на работу измельчителей или помольных мельниц, возрастают трудности при реализации фильтрования или отстаивания.
К р и с т а л л и з а ц и я — процесс образования твердой фазы в виде кристаллов из раствора и расплавов, а также из газов и паров применяется в химической, нефтехимической, металлургической промышленности для:
- выделения кристаллической фазы из растворов и расплавов;
- разделения смесей при однократной или многократной кристаллизации;
- глубокой очистки веществ от примесей.
Получение кристаллов различного размера в промышленно масштабе называют массовой кристаллизацией. Процесс кристаллизации происходит в случае, когда исходная фаза находится в состоянии пресыщения или переохлаждения. Пересыщенными называют растворы, в которых концентрация растворенного вещества выше его растворимости. Поскольку пересыщенные растворы неустойчивы, то из них выделяется избыточное количество растворенного вещества, т. е. происходит процесс кристаллизации. После прекращения выделения кристаллов раствор становится насыщенным. Его называют маточным, для отделения которого от твердой фазы используют отстаивание, фильтрование, центрифугирование и др.
Кристаллизация состоит из двух основных стадий — образование зародышей кристаллов и роста кристаллов, которые обычно протекают одновременно. Если скорость образования зародышей кристаллов больше скорости их роста, то получается большое числомелких кристаллов. Если же скорость появления зародышей кристаллов меньше скорости их роста, то образуются кристаллы большихразмеров, но в меньшем количестве.
Начало образования зародышей кристаллов происходит не во всем объеме раствора или расплава, а в центрах кристаллизации, которыми могут быть, например, различные механические приме онимогут возникать под влиянием шероховатостей стенок аппарата, других факторов. Для ускорения и равномерного образования зародышей во всем объеме раствора или расплава в аппарат пода затравку — мелкие частицы кристаллизующегося вещества, которые и являются зародышами кристаллов. Если нужно получить кристаллыкрупных размеров, то число затравочных кристаллов должно быть невелико.
Распространение получила кристаллизация из растворов очистки и разделения неорганических веществ. Процесс протею при значительно более низких температурах, чем при кристаллизации расплавов тех же веществ.
Кристаллизация из растворов является процессом, обратным растворению. Поэтому тепловой эффект кристаллизации равен величине и противоположен по знаку тепловому эффекту растворения. Это означает, что вещества, растворяющиеся с поглощением теплоты, кристаллизуются с выделением теплоты, и наоборот, промышленности используют два метода кристаллизации или комбинации: изотермический — перенасыщение раствора достигается удалением части растворителя путем выпаривания при постоянной концентрации (температура постоянна), и изогидрический — перенасыщение раствора достигается охлаждением раствора и сохранении массы растворителя.
Изотермическая кристаллизация используется для растворов, которых растворимость слабо увеличивается с ростом температур либо уменьшается. В этом случае охлаждение не позволяет достичь нужной степени перенасыщения.
Изогидрический метод используется для растворов, у которого наблюдается сильный рост растворимости с увеличением температуры.
Еще один метод кристаллизации - высаливание - в раствор вводят добавки (соли, кислоты и др.), снижающие растворимо кристаллизующегося вещества.
Рассмотренные методы кристаллизации включают физические процессы образования кристаллической фазы. Кристаллизацию химической реакцией называют аддуктивной. При этом в раствор добавляют реагент, образующий с выделяемым веществом комплексное соединение — аддукт. Полученное комплексное кристаллическое соединение отделяют от раствора, например, фильтрованием, и затем подвергают термическому разложению. Процесс кристаллизации включает несколько последовательных стадий: подготовку раствора (доведение раствора до состояния перенасыщения), собственно кристаллизацию, отделение кристаллов от маточника, промывку кристаллов и их сушку.
С у ш к а — процесс удаления влаги из вещества (обычно твердых тел) путем ее испарения и отвода образующихся паров. Часто тепловой сушке предшествуют механические способы удаления влаги (отстаивание, фильтрование, центрифугирование и др.).
При сушке в виде пара удаляется легколетучий компонент (вода, органический растворитель и т. д.). Этот процесс применяется на конечной стадии технологического процесса с целью обеспечения высоких физико-механических характеристик получаемых продуктов или на промежуточных стадиях, если удаление растворителя необходимо по технологическим соображениям. По физической сущности сушка является процессом тепломассопереноса и сводится к перераспределению и перемещению влаги под воздействием теплотыиз глубины высушиваемого материала к его поверхности и последующему ее испарению. В процессе сушки влажное тело стремится к состоянию равновесия с окружающей парогазовой средой, поэтому его температура и влагосодержание в общем случае являются функцией времени и координат.
Понятие влагосодержания w0 — отношение массы влаги тw, cодержащейсяв теле, к массе абсолютно сухого тела mc: w0 = mw/mc отличается от понятия влажности w, когда удаляется не вся влага: w = mw/(mc+mw) = w0/(1+w0). Но при малых значениях влагосодержания w0<<1 величина (1+w0)≈1 и величины w и w0 практически совпадают. Скорость процесса является функцией внутренней структуры материала и его теплофизических свойств, размеров, формы и состояния внешней поверхности.
По способу подвода теплоты различают сушки:
- конвективную — путем непосредственного контакта материала и сушильного агента. Подвод теплоты осуществляется с газовым потоком (воздух или смесь воздуха с продуктами сгорания топлива), который в процессе сушки охлаждается с увеличением своего влагосодержания;
- контактную (кондуктивную) — путем передачи теплоты от теплоносителя к материалу через разделяющую их стенку;
- радиационную — путем передачи теплоты инфракрасным излучением;
- сублимационную, при которой влага удаляется из материала в замороженном состоянии (обычно в вакууме);
- диэлектрическую, при которой материал высушивается в поле токов высокой частоты.
Процесс сушки широко используется в автомобильном производстве, при выполнении технического обслуживания и ремонта объектов транспорта.
Массообмен через полупроницаемые мембраны применяют для разделения смесей, очистки и концентрирования растворов, выделения высокомолекулярных соединений из растворов, содержащих низкомолекулярные компоненты, при обработке воды и водных растворов, очистке сточных вод, а также разделения газовых смесей, например, выделения кислорода из воздуха, получения обогащенного кислородом воздуха, выделения гелия и диоксида серы из природного газа и т. п.
Применение полупроницаемых мембран может дать значительный эффект при сочетании с ректификацией, адсорбцией, экстракцией и др. К мембранным методам разделения (разделяемая смесь соприкасается с полупроницаемой мембраной) относятся обратный осмос, ультрафильтрация, микрофильтрация, диализ, электрдиализ, испарение через мембрану и др. Вследствие особых свойств полупроницаемых мембран прошедшее через них вещество обогащается или обедняется одним или несколькими компонентами настолько полно, что продукт практически не содержит примесей, задерживаемых мембраной. И наоборот, применяя тот или иной мембранный метод разделения, можно получать в смеси перед мембраной компонент практически без примесей вещества, проходящего через мембрану.
Мембранные процессы классифицируются по виду основной движущейся силы процесса. Движущей силой мембранного процесса является градиент химического (для незаряженных частиц потока) или электрохимического (для заряженных частиц потока) потенциала.
Для расчетов таких процессов в качестве движущей силы принимают градиенты: давлений — баромембранные процессы (обратный осмос, нано-, ультра- и микрофильтрация), концентраций — диффузионно-мембранньте процессы (диализ, испарение через мембрану, мембранное разделение газов и др.), электрического потенциала — электромембранные процессы (электродиализ, электроосмос и др.), температур — термомембранные процессы (мембранная дистилляция и др.). В мембранных процессах возможно сочетание двух или даже трех названных выше движущих сил. Прошедший через мембрану продукт называется пермеатом, а оставшаяся перед мембраной разделяемая смесь — ретантом.
Не й т р а л и з а ц и я широко используется при очистке от вредных компонентов отработавших газов объектов транспорта, уходящих газов тепловых электростанций, котельных, испытательных станций, при очистке сточных вод, для выделения кислот, щелочей, солей, металлов на их основе.
Токсичность отработавших газов можно уменьшить с помощью реакторов, установленных в выпускной системе транспортного средства или на выходе топочного устройства. При этом степень превращения газов (%) в нейтрализаторе оценивается коэффициентом преобразования:
K = (cвх – свых)100/свх, (24)
где cвх, свых — концентрации токсичных компонентов в отработавших газах на входе и выходе нейтрализатора.
К устройствам нейтрализации двигателей с искровым зажиганием относятся термореакторы (дожигатели), окисляющие СхНу и СО2 до СО,и каталитические системы нейтрализации отработавших газов окислительного и бифункционального действия, восстанавливающие NOдо азота и кислорода и окисляющие СхНу и СО2 до СО. Для этих целей могут использоваться и системы поглощения вредныхвеществ адсорбционного типа, а также системы
подачи в отработавшие газы специальных добавок для усиления окислительных ивосстановительных процессов.
Принцип действия термореакторов (дожигателей) основан на доокислении продуктов неполного сгорания в термоизолированных камерах путем подачи дополнительно окислителя и поддержания высоких температур на всех режимах работы двигателя. Из рис. 2.10, где представлены температуры, при которых должна поддерживаться каталитическая реакция, следует, что для достижения эффективного окисления СхНу и СО в окислительном нейтрализаторе требуется поддерживать температуру на уровне 535 К, а в термическом реакторе — 800—1000 К[10].
Поэтому наиболее распространены системы нейтрализации каталитического действия, использующие в качестве катализаторов металлы платиновой группы: платину, палладий и родий.
Окислительный каталитический нейтрализатор содержит 1,5 —3 г платины (окисление СО и медленно сгорающих углеводородов — метана) и палладия (окисление быстросгорающих углеводородов):
СО+Н2О – СО2+Н2
СхНу + (х+у/4)О2 – хСО2+0,5уН2О
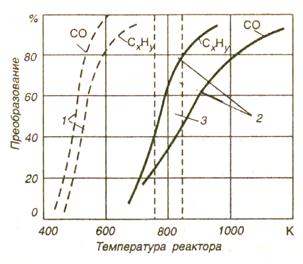
Рис. 17 - Сравнение эффективности окисления СО и СчНу каталитическим нейтрализатором (1) и термическим дожигателем (2); 3 – температура отработавших газов
Эффективность окислительных нейтрализаторов ограничена более низкой активностью окисления СхНу посравнению с окислением СО. При отравлении катализатором ухудшается активность окисления СхНу в следующем порядке: ацетилены, ароматические углеводороды, олефины и парафины; метан практически не окисляется, а активность окисления парафинов увеличивается с увеличением их молекулярной массы.
Содержание оксидов азота в отработавших газах в присутствии СО и Н2 при рабочих температурах можно снизить с помощью окислительно-восстановительных каталитических нейтрализаторов, где происходит восстановление NО до N2 (на бедных смесях) и аммиака NН3 (на богатых смесях):
NО+СО – 0,5N2+CO2
2NO+5CO+3H2O – 2NH3+5CO2
NO+H2 – 0,5N2+H2O
2NO+5H2 – 2NH3+2H2O
3NO+(CxHy) – N2+H2O+CO2+NH3
Чтобы после восстановления N0 образовывалось больше N2, чем NНЗ, катализатор должен содержать родий Rh (в отношении с платиной 1/5). На рис. 2.11 показано влияние температуры катализатора на снижение концентрации NО и преобразование в NНЗ для катализаторов из Рt и Ru.
Рутений занимает исключительное положение не только из-за высокой степени преобразования NО, но также и вследствие низкой степени преобразования в аммиак[11].
Таким образом, в данных устройствах происходит снижение концентрации продуктов горения при восстановлении NОи окислении СОи СхНу.
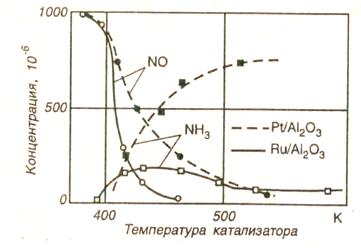
Рис. 18 - Сравнение эффективности образования аммиака и снижения концентрации NО на платиновых и рутениевых катализаторах[12]:
--- - Pt/Al2O3$- - Ru/Al2O3
Перспективный адсорбционно-каталитический нейтрализатор (DЕNОХ) эффективно работает как на бедных, так и на богатых смесях. Носитель из Аl203 покрыт катализатором из платины Рt и специальным веществом R, выполняющим функцию адсорбера. При работе на бедных смесях платиновый катализатор способствует окислению NO до NО2, который на материале Rадсорбируется в виде нитрата. Когда двигатель будет работать при α<1,0, то NО2 с участием СхНу, СО и Н2 восстанавливается на платиново-родиевом катализаторе.
Коэффициент преобразования NОх составляет 60% и в значительной степени зависит от соотношения СхНу/NОх, а также температуры.
При работе двигателя при α=1—1,05 кислорода в отработавших газах может не хватать для окисления на катализаторе всего количества образующегося в цилиндрах NО.
Улучшению условий работы адсорбционно-каталитическогого нейтрализатора при нарушении требуемого баланса между временем работы двигателя при α>1,0 и при α<1,0 может способствовать подача в выпускную систему (перед нейтрализатором) какого-либо топлива (например, Н2 или смеси 2Н2+СО, получаемой из метанола путем сухой конверсии). Это топливо, связывая избыточный кислород, будет создавать восстановительную среду, и увеличивать восстановление нитрата.
Нейтрализация отработавших газов дизелей осуществляется несколько иначе.
Процессы окисления (дожига) СО, СхНу сажи и восстановления NОх осуществляются в следующей последовательности: на первом этапе — дожиг сажи, на втором — восстановление NОх, на третьем — окисление СО и СхНу.
Для дожига сажи применяют катализатор с использованием оксидов ванадия с обеспечением электроразогрева носителя для инициирования процесса дожигания и объемного окисления сажи в электрическом поле высокого напряжения. Для восстановления NОх по данным НАМИ можно использовать медь, обеспечив ее электроразогрев и удаление окалины. Процессы окислення СО и СхНу не отличаются от процессов в каталитических нейтрализаторах двигателей с искровым зажиганием.
Дожиг сажи является реакцией между твердым телом и газом прямого отношения к нейтрализации не имеет. Каталитическим является процесс окисления содержащихся в отработавших газах продуктов неполного сгорания. Часть образующихся при этом на поверхности катализатора молекул лабильных веществ, в частности «осколков» молекул, так называемых радикалов, могут инициировать цепной процесс в газовой среде. Образуются молекулы новь веществ и новые активные свободные радикалы, но уже в газовой фазе на некотором расстоянии от поверхности катализатора. Это гомогенный процесс (в объеме) с гетерогенным зарождением (на поверхности катализатора). Активные радикалы, достигая поверхности частиц сажи, могут вызывать (в присутствии кислорода) процесс окисления, но уже при значительно более низких температурах чем при прогреве частиц сажи в присутствии только кислорода и катализатора.
Поэтому дожиг сажи осуществляется не непосредственно на поверхности катализатора, а в газовой фазе над поверхностью катализатора с помощью активных частиц-радикалов, образующихся на поверхности катализаторов и «сходящих» с нее в газовую фазу. В газовой фазе протекает процесс доокисления некоторых компонентов отработавших газов, что сопровождается достижением определенной концентрации радикалов над катализатором, и чем этот процесс будет интенсивнее, тем полнее будет сгорать сажа. Эффективный дожиг сажи может быть обеспечен при любом способе интенсификации процесса, в том числе при введении в систему активных частиц, образованных без участия катализатора (например, ввод водорода, ионизированного газа и т. п.). Ввод в зону дожига дополнительного количества кислорода, а в некоторых случаях горючего, также может интенсифицировать процессы окисления.
Для интенсификации процесса нейтрализации дополнительно используют высокочастотные электрические поля напряжением 1,5—2,0 кВ и частотой 0,2—0,4 кГц, что способствует выходу активных частиц с поверхности катализатора в объем.
Процесс восстановления оксидов азота при помощи накаленной меди заключается в следующем. Медь, подогретая до 800 К и выше вступает в химическую реакцию с оксидами азота, конечными продуктами которой являются оксид меди (окалина) и молекулярный азот. Скорость реакции резко возрастает с температурой. При этом происходит реакция восстановления меди из ее оксида в присутствии СО, но интенсивность реакции накаленной меди с NОх много выше, чем этой же меди с кислородом воздуха. Эффективность восстановления оксидов азота в отработавших газах дизелей прямо пропорциональна температуре меди, площади ее поверхности, а также времени контакта газов с этой поверхностью.
Окалина благодаря большим скоростям отработавших газов в дизеле хорошо отделяется, и, как показали опыты, 60—65%поверхности катализатора всегда остается чистой. Кроме того, при температуре 950—1000 Креакция меди с оксидами азота идет через слой окалины.
Нейтрализация кислот и растворов их солей в сточных водах осуществляют щелочами или солями сильных щелочей: едким натрием, едким калием, гашеной известью, доломитом, мрамором, мелом, магнезитом, содой. Нейтрализация щелочей в сточных водах осуществляется кислотами. На практике используют три способа нейтрализации сточных вод:
1) фильтрационный (фильтрация через насадки кусковых или зернистых щелочных материалов);
2) воднореагентный (добавление в сточную воду реагента в виде раствора или сухого вещества — извести, соды или шлака);
3) полусухой (перемешивание концентрированных кислотосодержащих сточных вод (гальванического раствора) с сухим реагентом (известью, шлаком) с последующим образованием нейтральной тестообразной массы).
Электрохимическая очистка сточных вод осуществляется электролизом и реализуется двумя путями: окислением веществ путем передачи электронов непосредственно на поверхность анода или через вещество-переносчик, а также в результате взаимодействия с сильными окислителями, образовавшимися в процессе электролиза. Наличие в сточной воде хлорид - ионов обусловливает появление при электролизе хлора, который является сильнейшим окислителем и способен вызвать глубокую деструкцию многих органических веществ в сточных водах.
Окисление применяют для очистки сточных вод гальванических производств, содержащих простые цианиды или комплексные цианиды цинка, меди, железа. Осуществляется в электролизерах (обычно прямоугольной формы) непрерывного или периодического действия. На аноде происходит окисление цианидов с превращением их в малотоксичные и нетоксичные продукты (цианиты, карбонаты, СО2, N2 ), а на катоде — разряд ионов водорода с образованием газообразного Н2и разряд ионов Сu2+, Zn2 + , Cd2+, образующихся при диссоциации комплексных анионов с содержанием СN-группы.
|
Дата добавления: 2014-01-13; Просмотров: 830; Нарушение авторских прав?; Мы поможем в написании вашей работы!