
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Виды равновесных потенциалов
|
|
|
|
Можно выделить следующие виды равновесных потенциалов:
1) электрод металл – ионы металла
Cu 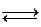 Cu +2 +2
Cu +2 +2 ; Zn
; Zn 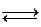 Zn +2 +2
Zn +2 +2 (3.д)
(3.д)
В этом случае (реакции 3.д) в равновесии с металлической фазой находятся ионы металла, из которого состоит эта фаза.
2) Окислительно - восстановительный (redox) электрод.
Fe +2 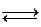 Fe +3; 2 H + +2
Fe +3; 2 H + +2
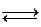 H 2
H 2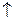 (3.е)
(3.е)
В этом случае (реакции 3.е) в равновесии находятся ионы (молекулы) в различной степени окисления, а металлический электрод (платина, золото и.т.д.) играет роль только переносчиков электронов.
3) потенциал Донана или мембранный потенциал.
Мембранный потенциал образуется двумя фазами, содержащими различные ионы, причём по меньшей мере один из них способен переходить через границу, а для другого такой переход затруднён. Природа затруднения – механическая (полупроницаемая мембрана) либо химическая (вследствие ионного обмена).
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 739; Нарушение авторских прав?; Мы поможем в написании вашей работы!