
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесные явления в растворах электролитов. Теория электролитической диссоциации. Ион - дипольное и ион - ионное взаимодействие в электролитах
|
|
|
|
Лекция 4. Основы теории электролитической диссоциации
Вопросы и задачи
1. Может ли существовать водородный электрод? Объясните.
2. Какие реакции могут протекать на кислородном электроде:
а. в кислой среде;
б. в щелочной среде.
Что представляет собой в этом случае избыточная фаза?
3. Какими свойствами должна обладать металлическая фаза окислительно-восстановительного электрода?
4. Используя справочные материалы предложите метод подбора окислительно-восстановительных электродов, обеспечивающих максимально возможное напряжение ячейки.
5. Используя справочные материалы напишите уравнения реакций ячейки для различных равновесных систем:
а. металл – ионы металла;
б. окислительно-восстановительных.
На предыдущих лекциях мы смогли убедиться на опыте (гальванический элемент), что в окислительно-восстановительных реакциях действительно переносятся электроны. Кроме того, мы дали определение равновесного потенциала и вообще равновесия. В условиях равновесия по данным внешнего баланса нет тока. Но существуют ли заряженные частицы, ионы в растворе в отсутствие тока?
Ведь буквально слово “электролит” означает разлагаемый электричеством (перевод с греч.). Этот термин принадлежит М.Фарадею, который считал, что разложение на ионы происходит только в результате действия электрического тока. Поэтому возникает важный вопрос: В чем природа проводимости электролитов? Существуют ли носители заряда в растворе или они возникают под действием электрического тока?
Первой теорией, объясняющей возникновение ионов в растворе, была теория литовского ученого Т.Гроттгуса (1805г). Он предложил так называемый “эстафетный механизм” возникновения зарядов (рис. 4.1). Благодаря реакции на границе и удалению положительно заряженного иона, на катоде возникает избыток отрицательного заряда, благодаря которому происходит разделение зарядов у близлежащих молекул и т.д. по эстафете. Но это означает, что разделение зарядов происходит только под действием тока, а в растворе заряды отсутствуют.
|
|
|

Рис. 4.1 “Эстафетный механизм ” возникновения зарядов в растворе.
Вторая гипотеза принадлежит М.Фарадею: молекулы растягиваются под действием электрического поля и так происходит их диссоциация, разложение.
Однако в дальнейшем оказалось, что это неверно: частично или полностью разложение происходит и без электрического тока, т.е. при растворении. Как это доказать?
При изучении растворов электролитов в середине XIX века был обнаружен ряд отклонений от законов разбавленных растворов:
1. изменение осмотического давления[*] 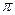 подчиняется следующему уравнению.
подчиняется следующему уравнению.
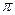 = CRT, (4.1)
= CRT, (4.1)
где C – концентрация раствора; R – универсальная газовая постоянная; Т – абсолютная температура.
Измерения показывали, что, например, осмотическое давление раствора сахара в воде описывалось этим соотношением. Однако применение уравнения (4.1), к водным растворам солей, например, к раствору NaCl, предполагало значительно более низкое значение p, чем получалось в эксперименте. Известный голландский ученный Я.Вант - Гофф предложил вводить поправочный коэффициент, названный изотоническим. Тогда для этих растворов можно записать соотношение (i > 1):
p= iCRT (4.2)
Получалось, что в таких растворах как будто бы большее число частиц.
2. Изменение давления пара растворителя над раствором неэлектролитов можно рассчитать следующим образом:
D p = 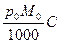 , (4.3)
, (4.3)
где р 0 – это давление пара над чистым растворителем; М 0- молекулярная масса растворителя; С – моляльная концентрация раствора.
|
|
|
Опять же для растворов электролитов совпадение экспериментальных данных и расчетных по уравнению (4.3) возможно было только в том случае, если вводился изотонический коэффициент i >1.
3. Изменение температур кипения и замерзания.Криоскопические и эбулиоскопические измерения (это измерения понижения температуры замерзания и повышения температуры кипения растворов по сравнению с чистыми растворителями), показали, что в растворах электролитов экспериментально измеренное понижение температуры замерзания и повышение температуры кипения оказались завышенными по сравнению с расчетными.
Подобные отклонения для растворов электролитов смогла объяснить теория шведского ученного С. Аррениуса, разработанная только в 1887г. Она позволила количественно показать природу процессов, протекающих в растворах электролитов. В основном эта теория сохранила свое значение до настоящего времени.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 602; Нарушение авторских прав?; Мы поможем в написании вашей работы!