
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионные равновесия в водных растворах. Количественное определение кислотности водных растворов. Понятие pH и pK. Гидролиз солей. Буферные растворы. Произведение растворимости
|
|
|
|
Лекция 5 Ионные равновесия в водных растворах
Благодаря теории электролитической диссоциации удалось определить, что такое кислота и что такое основание, а также количественно рассчитать степень кислотности растворов.
Из теории электролитической диссоциации следует, что кислота - это химическое соединение, которое в водном растворе диссоциирует с образованием ионов гидроксония (H3O + - гидратированных ионов водорода, которые в дальнейшем будут обозначаться просто H+) (5.а). Основание это соединение, диссоциирующее в водном растворе с образованием гидроксил - ионов (5.б).
HClO3 + H2O  H3O + +
H3O + +  (5.a)
(5.a)
KOH  K+ + OH- (5.б)
K+ + OH- (5.б)
Отсюда следует, что в зависимости от того, что преобладает в растворе ионы гидроксония или ионы гидроксила раствор будет кислотой или щелочью соответственно.
Я.Бренстед в 1923 году осуществил обобщение теории С.Аренниуса. По его определению кислота - это донор протонов, а основание - акцептор. Например, в реакции (5.а) HClO3 – кислота, а H2O – основание. Более того, можно записать:
 (5.в)
(5.в)
Из реакции (5.в) очевидна относительность понятия кислоты и основания. В реакции (5.в) CH3 COOH является основанием, а при взаимодействии с водой CH3COOH будет кислотой.
CH3 COOH + H2O 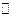 H3O+ + CH3 COOH- (5.г)
H3O+ + CH3 COOH- (5.г)
Из вышеизложенного видно, что необходима количественная характеристика силы кислоты и основания. Для получения этих характеристик рассмотрим для примера только водные растворы.
Запишем реакцию диссоциации воды:
H2O  H++OH- (5.д)
H++OH- (5.д)
Применяя к этому уравнению закон действующих масс, можно записать:
Kd = 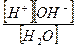 (5.1)
(5.1)
Известно, что при 25°C Kd = 3,24×10-18, 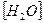 = 1000/18 = 55,5 моль/л (концентрация “воды в воде”). Тогда:
= 1000/18 = 55,5 моль/л (концентрация “воды в воде”). Тогда:
 = Kd ×
= Kd ×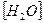 = Kив = 3.24×10-18×55,5 моль/л» 10-14 моль/л
= Kив = 3.24×10-18×55,5 моль/л» 10-14 моль/л
Константа Kив носит название ионное произведение воды.
|
|
|
Считая, что получаем:
получаем:
 = 10 -7 моль/л (5.2)
= 10 -7 моль/л (5.2)
В 1920 г. Я. Соренсен ввёл понятие pH
pH = -lg [ H+ ]. (5.3)
Учитывая уравнения (5.2) и (5.3), получаем при равенстве концентраций ионов водорода и гидроксила, что pH = 7.
Аналогично pH можно ввести понятие pOH:
pOH = - lg [ OH- ], (5.4)
Тогда очевидно, что:
pH + pOH = 14(5.5)
Для кислой среды pH < 7, для щелочной pH > 7, а в нейтральной среде pH = 7.
Для диссоциации кислоты можно записать аналогичное соотношение. Запишем его в общем виде:
AH 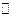 A- + H+ (5.ж)
A- + H+ (5.ж)
Для данного уравнения запишем закон действующих масс:
Ka = , (5.з)
, (5.з)
где Ка – константа диссоциации кислоты.
Введем понятие pK а -отрицательного логарифма константы ионизации кислоты:
pKа = - lgKa (5.6)
Если константа ионизации кислотыстремится к бесконечности, то есть кислота полностью диссоциирует, то pK ® - ¥. Для сильных кислот pKа отрицательно и чем больше его отрицательное значение, тем выше сила кислоты.
таблица 5.1
Значения pKа некоторых кислот
| Кислота | Константа диссоциации | pKa |
| HClO 4 (хлорная) | K a» 108 | pK a = - 8 |
| HCl (соляная) | K a» 103 | pK a = - 3 |
| HNO 3 (азотная) | K a» 102 | pK a = - 2 |
| HNO 2 (азотистая) | K a» 4×10-4 | pK a = 3,4 |
| HCN (синильная) | K a» 4×10-10 | pKa» 9,4 |
Рассмотрим поведение слабых кислот  в растворе.
в растворе. 

 Учитывая закон разведения В. Оствальда применительно к слабой кислоте (4.11) и (4.12), можно записать, что:
Учитывая закон разведения В. Оствальда применительно к слабой кислоте (4.11) и (4.12), можно записать, что:
[ H+ ] = Caa (5.7)
 (5.8)
(5.8)
Из (5.8) следует, что кислотность слабых кислот связана с константами их диссоциации. Учитывая уравнение (5.3), можно записать, что для слабой кислоты:
pH = 0,5 pKа – 0,5 lgCa, (5.9)
аналогично для слабого основания с учетом (5.5):
pH = 14 – 0,5 pKb + 0,5 lgCb, (5.10)
Kа, Kb, Ca, Cb – константы диссоциации и концентрации кислот и оснований соответственно.
Значения Ka и Kb приводятся в справочниках. По уравнениям (5.9) и (5.10) можно рассчитывать pH слабых кислот и оснований. Для сильных кислот и оснований необходимо использовать уравнения (5.3) - (5.5).
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 912; Нарушение авторских прав?; Мы поможем в написании вашей работы!