
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Щелочные аккумуляторы
Никель-железные (НЖ) и никель-кадмиевые (НК) аккумуляторы ламельного типа. Никель-железные и никель-кадмиевые щелочные аккумуляторы, в которых использованы электрохимические системы  Fe | NaOH | NiOOH Å и
Fe | NaOH | NiOOH Å и  Cd | KOH | NiOOH Å по сравнению со свинцовыми кислотными аккумуляторами имеют более низкие разрядные напряжения и КПД. Они дороже, хуже работают при низких температурах, имеют более низкие разрядные токи и большие внутренние сопротивления, которые увеличиваются к концу разряда. Вместе с тем, долговечность и прочность конструкций, простота обслуживания ламельных щелочных аккумуляторов являются несомненными их преимуществами, которые и обусловили большие по сравнению с кислотными аккумуляторами темпы роста производства щелочных аккумуляторов. Их используют на электрокарах, тягачах, рудничных электровозах в качестве тяговых, для освещения железнодорожных вагонов, запуска дизелей тепловозов, питания аппаратуры и т.п.
Cd | KOH | NiOOH Å по сравнению со свинцовыми кислотными аккумуляторами имеют более низкие разрядные напряжения и КПД. Они дороже, хуже работают при низких температурах, имеют более низкие разрядные токи и большие внутренние сопротивления, которые увеличиваются к концу разряда. Вместе с тем, долговечность и прочность конструкций, простота обслуживания ламельных щелочных аккумуляторов являются несомненными их преимуществами, которые и обусловили большие по сравнению с кислотными аккумуляторами темпы роста производства щелочных аккумуляторов. Их используют на электрокарах, тягачах, рудничных электровозах в качестве тяговых, для освещения железнодорожных вагонов, запуска дизелей тепловозов, питания аппаратуры и т.п.
На положительных пластинах НЖ и НК аккумуляторов токообразующие реакции протекают в твердой фазе с участием ионов электролита на границе раздела фаз. Установлено, что концентрация ионов Ni 3+ в электролите равна примерно 10-14 моль/л. Так как Ni (OH)2, из которого состоит активная масса положительных пластин в разряженном состоянии, слабо проводит ток (полупроводник n -типа с электропроводностью 10-9 См/см), к активной массе добавляют графит или чешуйчатый никель тонкого помола, которые обволакивают частицы активной массы и обеспечивают протекание электрохимических окислительно-восстановительных процессов.
При заряде анодному процессу отвечает равновесный потенциал, который будет зависеть также от активностей NiOOH и Ni (OH)2:
Ni (OH)2 → NiOOH + H + +  (5.ж)
(5.ж)
 H + + OH - → H 2 O (5.з)
H + + OH - → H 2 O (5.з)
Ni (OH)2 + OH -  NiOOH + H 2 O +
NiOOH + H 2 O +  (5.и)
(5.и)
Образующийся на поверхности зерен активной массы при заряде основной оксид никеля (III) - NiOOH (полупроводник p -типа с дырочной проводимостью) не искажает кристаллической решетки Ni (OH)2, проводимость активной массы быстро растет по мере ее окисления, и зарядный процесс может идти непрерывно, хотя диффузия протона из глубинных слоев твердой фазы (рис. 5.4а) протекает с небольшой скоростью.

Рис. 5.4 Образование активной массы на положительных пластинах щелочных аккумуляторов
При высоких скоростях анодного процесса на поверхности положительной активной массы образуются слои адсорбированного кислорода β - NiOOHO адс, а также может проходить побочная реакция: NiOOH + OH - → NiO 2 + H 2 O +  .
.
Кроме того, на положительном электроде при заряде идет побочный процесс выделения кислорода: 4 OH - → 2 H 2 O + O 2 + 4 , который ускоряется к концу заряда и приводит к снижению (~ на 20%) коэффициента использования тока.
, который ускоряется к концу заряда и приводит к снижению (~ на 20%) коэффициента использования тока.
После отключения НЖ и НК аккумуляторов от зарядных устройств потенциалы положительных электродов, а следовательно, и напряжение разомкнутой цепи (U рц) уменьшаются соответственно от U рц = 1,45 – 1,7 В до 1,37 – 1,41 В (НЖ) и 1,3 – 1,34 В для НК аккумуляторов. Это происходит за счет распада высших оксидов никеля и снижения активного кислорода в электроде при реакциях окисления воды, а также благодаря выравниванию активностей NiOOH и Ni (OH)2 при диффузии в твердой фазе.
Вследствие этих реакций происходит саморазряд положительных пластин, который может достигать ~15% в месяц и увеличивается примерно втрое при повышении температуры от 20 до 45°С.
При высоких скоростях разряда (катодный процесс, рис. 5.4б) при малой площади соприкосновения плохо проводящих частиц Ni (OH)2 с токоподводами (частицами графита) может произойти потеря контакта, т.е. часть глубинных слоев активной массы в ламельных электродах не будет принимать участия в токообразующем процессе.
Поэтому при эксплуатации ламельных НЖ и НК аккумуляторов приняты двухступенчатые шестичасовые режимы заряда.
Частные зарядно-разрядные кривые для положительных пластин приведены схематически на рис. 5.5.

Рис. 5.5 Зарядно-разрядные кривые для положительных пластин щелочных аккумуляторов
Вредными примесями к положительной активной массе являются Mg, Al, Fe (OH)3. При снижении примесей в графите с 1% до 0,15% емкость аккумуляторов увеличивается на 25-30%. Накопление кислорода на электроде улучшают добавки Ba (OH)2, CoSO 4 (3% Co к Ni) и LiOH, которые применяют в количествах не более 20 г/л в составных электролитах с раствором КОН плотностью 1,21 г/см3, и используют в аккумуляторах, работающих при повышенных (до 45°С) температурах. Действие ионов бария (~2% к массе никеля), адсорбирующихся на положительном электроде, заключается в диспергировании активной массы, что улучшает накопление на ней активного кислорода при заряде и более полное его использование при заряде.
На отрицательных пластинах НЖ и НК аккумуляторов механизмы токообразующих процессов идентичны. Реакции идут через промежуточные стадии образования ионов гипоферрита (или  ионов), например:
ионов), например:
Fe + 3 OH - → HFeO 2- + H 2 O + 2 (5.к)
(5.к)

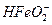 + H 2 O → Fe (OH)2 + OH - (5.л)
+ H 2 O → Fe (OH)2 + OH - (5.л)
Fe + 2 OH - = Fe (OH)2 + 2 . (5.м)
. (5.м)
Продукты реакции остаются на электродах, а не переходят в раствор.
Поляризация железного электрода вызвана замедленностью диффузии гидроксид-ионов (замедляется образование комплексного иона) и растет при понижении температуры и повышении плотности тока разряда. С понижением температуры на 1°С емкость НЖ аккумуляторов снижается на 2%.
И железные, и кадмиевые электроды склонны к пассивации вследствие экранирующего действия гидроксидных слоев и адсорбции на их поверхности кислорода. При этом для пассивации железного электрода достаточно адсорбции мономолекулярного слоя О 2, для кадмиевого – нескольких таких слоев. Депассиваторами железного электрода служат сульфид-ионы. Вредными являются примеси Mn, Al, Ca, Ni, Tl. Саморазряд железного электрода протекает по реакциям:
Fe + 2 H 2 O → Fe (OH)2 + H 2 и
2 Fe + 2 H 2 O + O 2 → 2 Fe (OH)2
и может составлять в зависимости от чистоты металла 40 – 100% в месяц. Для его снижения используют добавки серебра. Хранят НЖ аккумуляторы в разряженном состоянии.
Суммарные токообразующие реакции могут быть записаны уравнениями: для НЖ аккумуляторов:
2 NiOOH + Fe + 2 H 2 O = Fe (OH)2 + 2 Ni (OH)2, U рц = 1,48 В, (5.н)
для НК аккумуляторов:
2 NiOOH + Cd + 2 H 2 O = Cd (OH)2 + 2 Ni (OH)2, U рц= 1,44 В (5.о)
После разряда до 1В U рц обоих аккумуляторов приближается к 1,27 В. Разрядно-зарядные характеристики для НЖ и НК аккумуляторов открытого типа, получаемые суммированием соответствующих частных кривых имеют вид, представленный на рис. 5.6.

Рис. 5.6 Суммарные зарядно-разрядные кривые для никель - железных (НЖ) (а) и никель - кадмиевых (НК) (б) щелочных аккумуляторов
Уход за НЖ и НК аккумуляторами ламельного типа заключается в сохранении чистоты контактов и электролита, который следует менять ежегодно, в своевременной доливке в аккумуляторы дистиллированной воды, устранении замеченных неисправностей (снижение емкости из-за карбонизации электролита; образование “ползучих солей”; вспенивание электролита; нагревание контактов; вспучивание стенок корпуса аккумулятора).
|
|
Дата добавления: 2014-01-13; Просмотров: 833; Нарушение авторских прав?; Мы поможем в написании вашей работы!