
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сравнительная характеристика медных электролитов
|
|
|
|
Электролиты меднения можно разделить на две основные группы: кислые (сернокислые, борфтористоводородные) и сложные комплексные электролиты, имеющие преимущественно щелочную реакцию, в которых медь присутствует в виде отрицательно или положительно заряженных комплексных ионов.
Кислые электролиты просты и устойчивы по составу, позволяют работать при высоких плотностях тока, повышенных температурах. Медь выделяется при положительных значениях потенциалов, катодная поляризация не превышает 50 – 60 мВ. Осадки меди из кислых электролитов крупнокристаллические, но достаточно плотные.
Недостатком кислых электролитов является плохая рассеивающая способность и невозможность непосредственного меднения в них стали, цинковых сплавов.
При погружении в кислый электролит меднения эти металлы контактно вытесняют медь в виде пористого, плохо сцепленного с основой осадка. Поэтому перед меднением из кислых электролитов на поверхность стальных изделий предварительно наносят плотный слой меди, толщиной ~1 – 2 мкм из цианистых растворов, или слой никеля из обычного кислого электролита. Изделия из цинка и цинкового сплава, как правило, покрывают медью только из цинкового сплава.
Из комплексных щелочных электролитов наибольшее распространение получили цианистые электролиты. В цианистом электролите используется одновалентная медь, находящаяся врастворе в виде комплексных анионов типа [ Cu (CN)n](n-1)-, для восстановления которых требуется повышенная катодная поляризация. Константа нестойкости этого комплекса K = [ Cu +] [ CN -]n / [[ Cu (CN)n](n-1)-] очень мала, значения ее колеблются от 10-24 до 5·10-31 в зависимости от концентрации свободного цианида. В связи с этим равновесный потенциал меди в цианистых растворах значительно (на 1 В и больше) сдвинут в сторону электроотрицательных значений. В отсутствие высокого отрицательного значения потенциала меди в цианистых растворах контактного вытеснения ее железом не происходит.
|
|
|
Выход металла по току в цианистых электролитах меньше, чем в кислых растворах и, в отличие от последних, снижается с повышением тока. Это, а также высокая катодная поляризуемость, обеспечивает хорошую равномерность распределения металла по катодной поверхности.
Вследствие высокой катодной поляризации осадки меди из цианистых растворов имеют мелкозернистую структуру. Цианистые электролиты являются токсичными, неустойчивыми по составу, вследствие карбонизации свободного цианида под действием угольной кислоты.
Для замены цианистых электролитов разработаны нетоксичные растворы других комплексных солей меди (пирофосфатные, аммиакатные, щавелевокислые, роданистые, тиосульфатные, триполифосфатные и др.).
Наибольшего внимания заслуживают пирофосфатные электролиты. Они безвредны, просты и устойчивы по составу. Медь выделяется из пирофосфатных электролитов при повышенной катодной поляризации в виде плотных мелкокристаллических и относительно равномерных по толщине осадков. По рассеивающей способности они близки к цианистым.
Хорошие мелкозернистые осадки с более равномерным распределением по толщине, чем в кислых электролитах, получаются из аммиачных, этилендиаминовых и полиэтиленполиаминовых электролитов. Однако первые недостаточно устойчивы вследствие летучести аммиака, этилендиаминовые и полиэтиленполиаминовые небезвредны и относительно дороги.
Сернокислый электролит меднения.
Основными компонентами сернокислых электролитов являются сернокислая медь и серная кислота. Обычно применяемые для меднения сернокислые электролиты – это 1,2 н раствор сернокислой меди в серной кислоте. В таком растворе медь находится в виде двухвалентных ионов. В электролите в присутствии металлической меди наряду с ионами Cu 2+ в растворе находятся в незначительном количестве также и одновалентные ионы меди, появление которых возможно по реакции Cu + Cu 2+ = 2 Cu +, которая интенсивно идет при меньшем содержании серной кислоты.
|
|
|
Кроме того, при недостаточной кислотности может происходить гидролиз соли одновалентного металла с выпадением гидрооксида или оксида меди(I) в виде мелких взвешенных частиц Cu 2 SO 4 + H 2 O 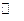 Cu 2 O + H 2 SO 4. Присутствие в электролите избыточного количества ионов одновалентной меди неблагоприятно сказывается на качестве покрытия - оно получается темным, шероховатым. При оптимальной кислотности и участии кислорода воздуха происходит окисление сернокислой соли меди(I) за счет кислорода воздуха и серной кислоты, особенно при применении воздушного перемешивания.
Cu 2 O + H 2 SO 4. Присутствие в электролите избыточного количества ионов одновалентной меди неблагоприятно сказывается на качестве покрытия - оно получается темным, шероховатым. При оптимальной кислотности и участии кислорода воздуха происходит окисление сернокислой соли меди(I) за счет кислорода воздуха и серной кислоты, особенно при применении воздушного перемешивания.
2 Cu 2 SО 4 + O 2 + 2 H 2 SO 4 → 4 CuSO 4 + H 2 O (12.а)
При этом происходит уменьшение концентрации серной кислоты и обогащение раствора сернокислой медью.
Таким образом, кислота в электролите меднения необходима прежде всего для предупреждения накопления одновалентной меди и гидролиза закисной меди, отрицательно влияющей на качество осадка. Кроме того, в присутствии серной кислоты увеличивается электропроводность раствора и уменьшается активность ионов меди, что способствует повышению катодной поляризации и образованию на катоде мелкозернистых осадков. Оптимальная концентрация серной кислоты в электролите меднения составляет 1 – 1,5 г-экв/л.
Концентрацию сернокислой меди выбирают в соответствии с принятыми плотностями тока и концентрацией серной кислоты в ванне. Практически применяют растворы, содержащие 200 – 250 г/л CuSO 4·5 H 2 O.
Электродные процессы, главным образом, заключаются в разряде двухвалентных ионов на катоде и ионизации меди на аноде. Предполагается, что разряд двухвалентных ионов меди в сернокислом электролите протекает в две стадии по схеме:
Cu 2+ + 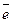 → Cu + (12.б)
→ Cu + (12.б)
Cu + + 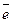
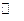 Cu (12.в)
Cu (12.в)
В области высоких перенапряжений скорость процесса контролируется стадией перехода (12.б) при низких перенапряжениях обнаружены диффузионные затруднения, которые могут быть связаны с перемещением ад-атомов к местам вхождения их в кристаллическую решетку.
|
|
|
При некоторых условиях электролиза наряду с выделением металлической меди катодный процесс протекает с образованием в растворе одновалентных ионов Cu + вследствие неполного восстановления двухвалентных ионов. Это вызывает снижение выхода меди на катоде, что происходит в большей степени, чем ниже плотность тока и выше температура (табл. 12.1).
Таблица 12.1
Влияние плотности тока и температуры на выход по току
(2н CuSO 4 + 1н H 2 SO 4)
| Температура °С | Плотность тока i k, А/дм2 | Катодный выход по току η % |
| 0,3 1,0 |
Наибольшее применение находят электролиты, содержащие 150 – 250 г/л CuSO 4 ·5 H 2 O и 50 – 70 г/л H 2 SO 4. Электролиз ведут при t = 80 – 40 °С и плотности тока i k = 0,5 – 2 А/дм2. Введение в сульфатный электролит 8 – 10 мл/л этилового спирта способствует предотвращению образования ионов одновалентной меди. Плотность тока при меднении может быть повышена до 3 – 4 А/дм 2, если электролит перемешивать очищенным сжатым воздухом или перемещением катодных штанг. Вследствие этих мер повышается катодная предельная плотность тока. Несмотря на высокую кислотность электролита, выделения водорода на катоде не происходит вплоть до предельного тока диффузии ионов меди. Это объясняется тем, что при данных условиях потенциалы выделения меди имеют более положительные значения, чем потенциалы выделения водорода (нормальные потенциалы окислительно-восстановительных реакций: Cu / Cu + = +0,51 B; Cu / Cu 2+ = +0,33 B; Cu +/ Cu 2+ - +0,15 B).
Кроме двух основных компонентов: CuSO 4 и H 2 SO 4 в сернокислый электролит меднения вводят в небольшом количестве органические вещества, обладающие поверхностно-активными свойствами.
Для повышения равномерности покрытий при нанесении их на детали сложной конфигурации используют электролиты с повышенной концентрацией серной кислоты. Электролиты такого типа содержат 90 – 110 г/л CuSO 4∙5 H 2 O и 100 – 150 г/л H 2 SO 4.
|
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 863; Нарушение авторских прав?; Мы поможем в написании вашей работы!