
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пирофосфатные электролиты
|
|
|
|
Для замены токсичных цианидных электролитов предложен ряд других, в числе которых дифосфатные, этилендиамидные, полиэтиленполиаминовые, аммиакатные и др.
Первый из них в настоящее время можно считать наиболее перспективным для производства. Затруднения при его применении связаны с двумя обстоятельствами: дефицитностью основного компонента – дифосфата калия и необходимостью особенно тщательного выполнения операций технологического процесса, предотвращения загрязнения электролита.
При смешивании растворов сульфатов меди и дифосфата калия образуется дифосфат меди Cu 2 P 2 O 7, который растворяясь в избытке K 4 P 2 O 7 дает комплексное соединение K 2[ Cu (P 2 O 7)], или при большей концентрации растворяющего компонента K 6[ Cu (P 2 O 7)2].
В зависимости от рН и концентрации свободных ионов 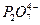 в растворе могут существовать в различных соотношениях ионы меди [ CuP 2 O 7]2- и [ Cu (P 2 O 7)2]6-, константы нестойкости которых, соответственно, равны 2·10-9 и 2·10-13.
в растворе могут существовать в различных соотношениях ионы меди [ CuP 2 O 7]2- и [ Cu (P 2 O 7)2]6-, константы нестойкости которых, соответственно, равны 2·10-9 и 2·10-13.
В щелочном растворе при рН > 8 и достаточном избытке свободных ионов 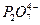 медь находится преимущественно в виде шестизарядных комплексных ионов [ Сu (P 2 O 7)2]6-, которые образуются в результате диссоциации:
медь находится преимущественно в виде шестизарядных комплексных ионов [ Сu (P 2 O 7)2]6-, которые образуются в результате диссоциации:
K 6[ Cu (P 2 O 7)2]  6 K + + [ Cu (P 2 O 7)2]6- (12.д)
6 K + + [ Cu (P 2 O 7)2]6- (12.д)
При уменьшении рН возрастает относительная концентрация ионов [ CuP 2 O 7]2- вследствие взаимодействия [ Cu (P 2 O 7)2]6- с ионами водорода по реакции
[ Cu (P 2 O 7)2]6- + 4 Н +  [ CuP 2 O 7]2- + H 4 P 2 O 7 (12.е)
[ CuP 2 O 7]2- + H 4 P 2 O 7 (12.е)
В слабокислых растворах при рН 5 – 7 и незначительном содержании свободных ионов 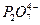 , наряду с ионами [ Сu (P 2 O 7)2]6- и [ CuP 2 O 7]2-, могут присутствовать комплексы [ CuHP 2O7]- и [ CuH (P 2 O 7)2]5-.
, наряду с ионами [ Сu (P 2 O 7)2]6- и [ CuP 2 O 7]2-, могут присутствовать комплексы [ CuHP 2O7]- и [ CuH (P 2 O 7)2]5-.
Выделение меди на катоде происходит преимущественно в результате восстановления двузарядных комплексов, образующихся вследствие диссоциации шестизарядных комплексов по реакциям:
|
|
|
[ Cu (P 2 O 7)2]6- 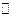 [ CuP 2 O 7]2- +
[ CuP 2 O 7]2- + 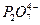 (12.ж)
(12.ж)
[ CuP 2 O 7]2- + 2 → Cu +
→ Cu + 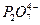 (12.з)
(12.з)
При высоком значении рН возможно прямое восстановление комплекса
[ Cu (P 2 O 7)2]6- + 2 = Cu + 2
= Cu + 2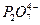 (12.и)
(12.и)
Разряд ионов меди характеризуется значительной поляризацией, которая возрастает с увеличением в растворе концентрации свободных ионов 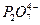 и значения рН. Поляризация обусловлена двумя факторами: пассивированием поверхности катода вследствие адсорбции
и значения рН. Поляризация обусловлена двумя факторами: пассивированием поверхности катода вследствие адсорбции 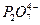 , образования фазовых пленок (Cu 2 O, Cu 2 P 2 O 7) при низких плотностях тока и затруднением подвода к катоду разряжающихся комплексных анионов меди, которые возрастают с увеличением плотности тока.
, образования фазовых пленок (Cu 2 O, Cu 2 P 2 O 7) при низких плотностях тока и затруднением подвода к катоду разряжающихся комплексных анионов меди, которые возрастают с увеличением плотности тока.
Для образования [ Cu (P 2 O 7)2]6- поддерживают соотношение концентраций Cu2+: 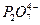 = 1: (7 – 8).
= 1: (7 – 8).
При оптимальном значении рН = 8,0 – 8,5 в дифосфатном электролите достигается максимальная концентрация комплексных ионов [ Cu (P 2 O 7)2]6-.
Анодный процесс в дифосфатных электролитах отличается образованием при определенных условиях на поверхности меди пассивирующей оксидной или солевой пленки, что может привести к снижению анодного выхода металла по току.
Для стабилизации анодного процесса в электролит добавляют сегнетовую соль, щавелевую, лимонную, триоксиглутаровую кислоту.
В промышленности используют дифосфатные электролиты следующих составов (г/л) и режимы электролиза:
1. 80 – 90 CuSO 4·5 H 2 O; 350 – 370 K 4 P 2 O 7; 20 - 30 NH 4 NO 3; pH ~ 8,3 – 8,7; t = 40 - 50°C, i k = 0,8 – 3 А/дм2
2. 30 – 65 Cu 2 P 2 O 7·3 H 2 O; 260 – 270 K 4 P 2 O 7; 9 – 10 KH 2 PO 4; 5 – 4 KNO 3, аммиак (20%) до рН ~ 8,3 – 8,5; t = 50 - 55oС, i k = 1,5 – 5 А/дм2
3. 85 – 90 CuSO 4·5 H 2 O; 350 – 360 K 4 P 2 O 7; 0,002 – 0,003 селенита натрия, рН ~ 8,3 – 8,7, t = 30 – 50oC, i k = 1 – 2 А/дм2.
Соотношение поверхностей катода и анода 1: (2 3). Покрытия, полученные в электролите 1, малопористые и могут быть использованы для защиты стальных деталей от цементации, электролиты 2 и 3 предназначены для получения покрытий значительной толщины, в частности для гальванопластики.
3). Покрытия, полученные в электролите 1, малопористые и могут быть использованы для защиты стальных деталей от цементации, электролиты 2 и 3 предназначены для получения покрытий значительной толщины, в частности для гальванопластики.
|
|
|
С целью интенсификации процесса меднения при комнатной температуре и большего подавления реакции контактного обмена при осаждении покрытий на сталь в дифосфатный электролит вводят комплекс органических красителей.
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 611; Нарушение авторских прав?; Мы поможем в написании вашей работы!