
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Перелік літератури
|
|
|
|
Где
I — интенсивность рассеяния света;
I0 — интенсивность падающего света в направлении, перпендикулярном к лучу падающего света;
К — константа, зависящая от показателей преломления дисперсионной среды и дисперсной фазы частиц;
n — число частиц;V — объём частиц; l — длина волны падающего света.

n Окраска золей
n связана с избирательным поглощением световых лучей.
n Если золь только рассеивает, а не поглощает световые лучи — он бесцветен.
n Опалесценция - рассеяние света в коллоидных системах и изменение окраски коллоида
n По Рэлею: светорассеяние обратно пропорционально длине волны падающего света
n Дихроизм — наложение опалесценции на собственную окраску золя.
n Ультрамикроскопия использует эффект рассеяния света отдельными частицами.
n В 1903 году Зигмонди,: наблюдения на тёмном фоне при боковом освещении.
n С=N/V, где
n N – число световых точек
n V-объем
n Для электронного микроскопа увеличение - 900 000 раз.
n Рентгеноструктурный анализ - используется дифракция рентгеновских лучей, направляемых на частицу под разными ракурсами
n СТРОЕНИЕ МИЦЕЛЛ
n Мицелла - гетерогенная микросистема, которая состоит из микрокристалла дисперсной фазы, окруженного сольватированными ионами стабилизатора.
 | |||
 |
n Ядро мицеллы - микрокристалл малорастворимого вещества, на поверхности которого адсорбированы, потенциалопределяющие ионы, сообщающие заряд ядру мицеллы.
n Противоионы вместе с ядром составляют гранулу:
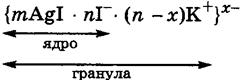 |
n Остальные противоионы, образуют диффузный слой.
 |
• Межфазным потенциалом –(электродинамическим)(фи) называется потенциал ДЭС на границе раздела между твердой и жидкой фазами в мицелле (на схемах мицеллы - граница АА).
|
|
|
• Электрокинетическим потенциалом (дзета) называется потенциал на границе скольжения между адсорбционной и диффузионной частями ДЭС
• ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ В ДИСПЕРСНЫХ СИСТЕМАХ
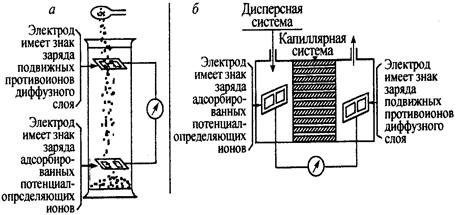
• 1.Электрофорезом называется направленное движение заряженных частиц дисперсной фазы относительно дисперсионной среды под действием электрического поля.
 |
Скорость движения частиц:
• ei
• V= --------,
• 6пRU
• Электроосмосом называется направленное движение дисперсионной среды (жидкости) в капиллярной системе под действием электрического тока.
 |
•. 3.Потенциалом седиментации (Дорна) называется разность потенциалов, возникающая при оседании частиц дисперсной фазы в жидкой дисперсионной среде.
• 4.Потенциалом течения (Квинке) называется разность потенциалов, возникающая при протекании через систему жидкой дисперсионной среды.
• Посмотрим схему установок
 |
• Устойчивость коллоидных растворов
• Седиментационная устойчивость - способность частиц дисперсной фазы находиться во взвешенном состоянии и не оседать под действием сил тяжести.
• Для коллоидных растворов она малыми размерами частиц и их интенсивным броуновским движением.
• Агрегативная устойчивость - способность частиц дисперсной фазы противодействовать их слипанию между собой и тем самым сохранять неизменными свои размеры.
• Причина а.у. -наличие на поверхности частиц "рыхлой" ионной атмосферы из гидратированных противоионов, которая увеличивает сродство коллоидных частиц к дисперсной среде, препятствует их слипанию
• В результате:
• - электростатического отталкивания одноименно заряженных частиц за счет большого скопления противоионов в области контакта ионных атмосфер;
|
|
|
• - расклинивания за счет упругих свойств гидратных оболочек, окружающих противоионы и состоящих из ориентированных (упорядоченных) диполей воды;
• - расклинивания за счет осмотического всасывания молекул растворителя в область контакта ионных атмосфер, т. е. в область большого скопления противоионов.
• См. схему:
 |
• Коагуляция –
• процесс слипания коллоидных частиц с образованием более крупных агрегатов из-за потери коллоидным раствором агрегативной устойчивости
• Коагуляцию можно вызвать воздействиями:
• -добавлением электролита,
• -концентрированием коллоидного раствора,
• -изменением температуры,
• -действием ультразвука,
• -электромагнитного поля и др.
• Теории коагуляции
• 1. Теория Фрейндлиха:
• а/ коагуляция наступает, когда заряд коллоидной частицы понижен до критического значения;
• б/ понижение заряда обусловлено адсорбцией и замещением компенсирующих ионов на ионы коагулятора.
• 2. Теория Мюллера: коагуляция обязана понижению заряда двойного электрического слоя в результате сжатия двойного электрического слоя и перехода ионов из диффузного слоя в адсорбционный..
• 3. из современных теорий коагуляции – теория
• Б.В.Дерягина и Л.Д.Ландау.
• ---сближению частиц, препятствует расклинивающее давление,
• ---- Препятствуют сближению частиц также прилегающие к частице молекулы воды, обладающие повышенной вязкостью и упругостью.
n Коагуляция под действием электролитов.
n Для каждого электролита необходима своя минимальная концентрация, называемая порогом коагуляции (спк).
n Порогом коагуляции называется минимальное количество электролита, которое надо добавить к коллоидному раствору, чтобы вызвать явную коагуляцию
n где сПК — исходная концентрация раствора электролита; VЭЛ — объем раствора электролита, добавленного к коллоидному раствору; VКР -объем коллоидного раствора.
n Величина, обратная порогу коагуляции, называется коагулирующим действием (у):
n У = 1/Спк
n
n Коагулирующее действие электролитов подчиняется правилу Шульце — Гарди:
n 1.коагуляцию вызывают любые ионы, которые имеют знак заряда, противоположный заряду гранул.
|
|
|
n 2.Коагулирующее действие ионов (у) тем сильнее, чем выше заряд иона-коагулянта - прямо пропорционально его заряду в шестой степени:
n у = f(z6).
Примеры:
---коагуляция золя Agl с по-тенциалопределяющими ионами - анионы I-);
y(Na+): у(Са 2+): yАl 3+) = 1: 64: 729.
-----коагуляция золя Agl (потенциалопределяющие ионы -катионы Ag+),
КС1, K2SO4, K3[Fe(CN)6]
у(С1-): y(SO4 2-): y[Fe(CN)6]3- = 1: 64: 729.
n Механизм коагуляции.
n Роль электролитов при коагуляции заключается в уменьшении расклинивающего давления между сближающимися коллоидными частицами. Это может происходить двумя путями:
n -за счет уменьшения заряда поверхности ядра, т. е. за счет снижения межфазного потенциала
n - за счет уменьшения толщины (сжатия) ионных атмосфер мицелл
n Два вида коагуляции:
n нейтрализационная и концентрационная.
n Нейтрализационная коагуляция наступает под действием электролита, который химически взаимодействует с потенциалопределяющими ионами, связывая их в прочное соединение и уменьшая заряд поверхности ядра.
 |
n Концентрационная коагуляция –за счет ионов добавленного электролита, которые являются противоионами для данных мицелл, они проникают внутрь гранулы, сжимая (уплотняя) ионную атмосферу мицеллы вокруг ядра
 |
n Кинетика коагуляции
 |
n Коагуляция смесями электролитов:
n 1. аддитивное действие,
n 2. антагонизм
n 3. синергизм
n Аддитивность
n - это суммирование коагулирующего действия ионов, вызывающих коагуляцию - не взаимодействуют химически между собой.
n Например, смесь солей КС1 и NaNO3
n Антагонизм
n — это ослабление у электролита в присутствии другого- ионы связываются в нерастворимое соединение.
n Например, у РЬ 2+ по отношению к отрицательно заряженным гранулам ослабляется в присутствии NaCl:
n РЬ 2+ + 2Сl-= РЬС12
n Синергизм
n — это усиление у одного электролита в присутствии другого- - химическое взаимодействие c образованием многозарядного иона, обладающего очень высокой коагулирующей способностью.
|
|
|
n FeCl3 + 6KCNS —K3[Fe(CNS)6] + 3KC1
n
n Взаимная коагуляция — слипание разноименно заряженных гранул коллоидных растворов..
n Привыкание золя - при медленном добавлении электролита коагуляция может не наступить, а если этот же электролит добавлять быстро, то коагуляция наступит.
n Пептизация
n - процесс, обратный коагуляции - превращение осадка, образовавшегося в результате коагуляции, в устойчивый коллоидный раствор.
n Условия пептизации:
n —свежеполученные осадки;
n — необходимо добавление небольших количеств электролита-пептизатора, в ином случае может вновь наступить коагуляция;
n — пептизации способствуют перемешивание и нагревание.
n
n «Коллоидной защитой
n называется повышение агрегативной устойчивости лиофобных золей при добавлении к ним ВМС.
n Механизм - вокруг мицелл коллоидного раствора образуются адсорбционные оболочки из гибких макромолекул ВМС.
n  .
.
n Золотое число — это количество мг сухого полимера [например, желатины], защищающего 10 мл красного гидрозоля золота от коагуляции 1 мл 10% раствора поваренной соли.
n Эту величину [0,01 мг] Зигмонди назвал «золотым числом» желатины.
n Основными условиями защитного действия являются:
n — хорошая растворимость ВМС в дисперсионной среде коллоидного раствора;
n — хорошая адсорбируемость молекул ВМС на коллоидных частицах;
n —большая концентрация ВМС, полностью покрывающего всю поверхность мицелл.
- Бугаєнко Г. О. Методи математичної фізики. – К.: Вища школа, 1970. – 310 с.
- Будак Б. М., Самарский А. А., Тихонов А. Н. Сборник задач по математической физике. – М.: Наука, 1980. – 688 с.
- Мэтьюз Дж., Уокер Р. Математические методы физики. – М.: Атомиздат, 1972. – 392 с.
|
|
|
|
Дата добавления: 2014-01-13; Просмотров: 711; Нарушение авторских прав?; Мы поможем в написании вашей работы!