
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетические уравнения для гетерогеннокаталитических реакций
 |
Существуют [5] методы получения кинетических уравнений для реакций, протекающих в присутствии гетерогенных катализаторов. Их можно применить к случаям, когда лимитирующей стадией является адсорбция, десорбция или одна из стадий реакции на поверхности. В этом случае скорость реакции совпадает со скоростью самой медленной стадии. Остальные стадии можно считать равновесными и записать для них константы равновесия. Для простейшего случая мономолекулярной реакции A «R Хоугеном и Уотсоном предложены кинетические уравнения общего вида
«R Хоугеном и Уотсоном предложены кинетические уравнения общего вида
v =
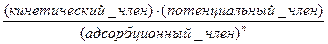 ,
,
где v – скорость реакции.
Кинетический член содержит концентрацию активных центров, константу скорости лимитирующей стадии и в большинстве случаев адсорбционные константы. Этот член уравнения используется для сравнения каталитических свойств различных катализаторов.
Адсорбционным членом описывается доля покрытия активных центров. Показатель степени n соответствует числу активных центров, участвующих в элементарной реакции. Потенциальный член характеризует движущую силу реакции удаление газовой фазы от состояния термодинамического равновесия.
Хоуген и Уотсон вывели указанные члены для ряда механизмов реакций. В качестве примера в табл. 1 приведены некоторые системы уравнений для реакции A«R.
Таблица 1.
Кинетические уравнения Хоугена – Уотсона для реакции А«R.
| Лимитирующая стадия | Потенциаль- ный член | Кинетичес- кий член | Адсорбционный член | n |
| Адсорбция A | pA- 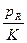
| kcL | (1+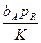 +bRpR) +bRpR)
| |
| Десорбция R | pA- 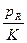
| kKbRcL | (1+bApA+KbRpA) | |
| Реакция на поверхности | pA- 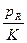
| bAcL | (1+bApA+bRpA) | |
| Диссоциативная адсорбция А | pA- 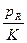
| kbAcL | (1+2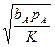 +bRpR) +bRpR)
| |
| Реакция на поверхности после диссоциативной адсорбции А | pA- 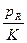
| kbAcL | (1+2 + bRpR) + bRpR)
|
|
|
|
Используемые обозначения:
- bi -константа адсорбционного равновесия компонента i;
- K - константа термодинамического равновесия;
- k - константа скорости реакции;
- pi - парциальное давление компонента i.
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 377; Нарушение авторских прав?; Мы поможем в написании вашей работы!