
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы получения гидроксида алюминия
Классификация оксидов алюминия.
Границы d-области сильно зависят от количества примесей и степени окристаллизованности бемита.
Гелеобразный бемит- 3000С 9000С 10000С 12000С
(псевдобемит) ® g ® d ® q(+a) ® a-А12О3
Все гидроксиды, кроме диаспора, при нагревании до 2000С и выше начинают переходить в g - А12О3.
Тем не менее, до сих пор не существует единой точки зрения на ход термического превращения гидроксидов алюминия в оксиды. Природа возникающих переходных фаз окиси алюминия и последовательность их образования зависят от исходного вещества, его дисперсности, дефектов строения и т.д.
Оксид алюминия проявляет все качества хорошего носителя. Он является амфотерным, т.е. в основной среде проявляет кислотные свойства, а в кислой – основные. Ценным для носителя качеством является высокая температура плавления оксида алюминия – немного выше 20000С. Он обладает способностью стабилизировать мелкодисперсные частицы катализатора, имеющего более низкую температуру плавления. Т.е. оксид алюминия предотвращает их спекание или слипание, являясь как бы темостабилизатором катализатора.
Частичная дегидратация гидроксидов алюминия приводит к соединениям с общей формулой А12О3×хН2О, где 0 < х < 1, которые, как правило, плохо окристаллизованы. Именно эти соединения используются в качестве носителей для катализаторов. Существует несколько основных кристаллических фаз оксида алюминия, обозначаемых греческими буквами: a, c, g, d, h, q и др. Природа получаемого при прокаливании продукта зависит от природы исходного гидроксида (гиббсит, бемит и др.) и от условий прокаливания. В ходе дегидратации происходит ряд последовательных превращений, во всех случаях окончательным продуктом дегидратации является корунд (a - А12О3).
В систематической классификации оксидов основным признаком является температура, при которой оксид образуется из гидроксида [19].
Низкотемпературные оксиды А12О3×хН2О, где 0 < х < 0,6, получают при температурах прокаливания до 6000С. Это g - группа оксидов, к которой относятся модификации g, h, r, c. Решетки g- и h- оксидов алюминия очень близки по строению к решетке шпинели MgAl2O4. Элементарная ячейка оксида алюминия этого типа образована в результате кубической плотнейшей упаковки 32 атомов кислорода. В g- оксиде алюминия по 24 катионным позициям (16 октаэдрических и 8 тетраэдрических) распределено 21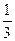 атомов алюминия. В данном случае решетка шпинели по рентгенографическим данным является сильно разупорядоченной.
атомов алюминия. В данном случае решетка шпинели по рентгенографическим данным является сильно разупорядоченной.
Высокотемпературные оксиды – это почти безводный А12О3. Это d - группа оксидов. Температура их получения от 900 до 10000С.
a-А12О3 характеризуется наиболее плотной упаковкой компонентов кристаллической решетки. Это корунд, его твердость равна 9 (у алмаза – 10). У корунда полностью отсутствуют ОН- группы, в отличие от g-А12О3, ОН- группы которой и определяют ее активность.
Между оксидами алюминия различных кристаллических модификаций существуют и химические различия. g-А12О3 растворима в кислотах, a - А12О3 – нерастворима, она может лишь сплавляться с NaOH.
|
Дата добавления: 2014-01-14; Просмотров: 900; Нарушение авторских прав?; Мы поможем в написании вашей работы!