
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Образование и утилизация кетоновых тел
Факторы, связанные с низким или высоким уровнем ХС ЛПВП
Факторы, влияющие на уровень ЛПНП у человека
Роль нарушений обмена холестерола в развитии атеросклероза
Регуляция синтеза холестерола
ГМГ-КоА-редуктаза: синтез фермента затормаживается холестеролом; вариабельность активности в течение дня; активность усиливает инсулин, уменьшает глюкагон; активность регулируется за счет фосфорилирования/дефосфорилирования. Ингибиторы используются в качестве лекарственных препаратов для лечения атеросклероза (мевастатин, мевакор, ловастатин).
Аккумуляция холестерола в сосудистой стенке происходит вследствие дисбаланса между поступлением его в интиму сосудов и его выходом. В центрах накопления холестерола формируются структуры — атеромы. Существует два фактора, которые вызывают дисбаланс в обмене холестерола: изменения частиц ЛПНП (гликозилирование, перекисное окисление липидов, гидролиз фосфолипидов, окисление апо В); неэффективное высвобождение холестерола из эндотелия сосудистой стенки циркулирующими в крови ЛПВП. Факторы, влияющие на уровень ЛПНП, и факторы, связанные с низким или высоким уровнем ХС ЛПВП у человека, представленные в таблицах 14.1 и 14.2 соответственно.
Таблица 14.1
| Повышение ЛПНП | Снижение ЛПНП |
| Пол — у мужчин выше, чем у женщин в пременопаузе, и ниже, чем у женщин в постменопаузе | |
| Старение | Новорожденные |
| Насыщенные жиры в диете | Полиненасыщенные жиры в диете |
| Высокое потребление холестерина | Низкое потребление холестерина |
| Диета с низким содержанием грубых волокнистых продуктов | Диета с высоким содержанием грубых волокнистых продуктов |
| Потребление алкоголя | Воздержание от алкоголя |
| Беременность | Роды |
| Ожирение | Потеря массы тела |
| Диабет | Эффективное лечение диабета |
| Гипотиреоз | |
| Болезнь Кушинга | |
| Уремия | |
| Нефроз | |
| Наследственные гиперлипидемии |
Таблица 14.2
| Связь с низким уровнем ХС ЛПВП | Связь с высоким уровнем ХС ЛПВП |
| Принадлежность к мужскому полу | Принадлежность к женскому полу |
| Прогестагены, андрогены | Эстрогены |
| Ожирение | Снижение массы тела |
| Гипертриацилглицеролемия | Высокая физическая активность |
| Потребление большого количества углеводов | Умеренное потребление алкоголя |
| Диабет у взрослых | |
| Курение |
Кетоновые тела являются водорастворимыми формами липидных энергетических источников. Двумя основными видами кетоновых тел являются ацетоацетат и b-гидрокси-бутират. b-гидроксибутират — это восстановленная форма ацетоацетата. Третьим видом является ацетон.
1. Свойство кетоновых тел: кетоновые тела растворимы в воде.
2. Функция кетоновых тел: источники энергии для мышц; при продолжительном голодании может использоваться центральной нервной системой.
Ацетоацетат образуется в клетках печени из ацетил-КоА (рис. 14.3). Образование происходит в митохондриальном матриксе. Печень служит главным местом образования кетоновых тел благодаря высокому содержанию ГМГ-КоА синтазы в митохондриях гепатоцитов.
При голодании усиливается липолиз, растет уровень глюкагона и концентрация цАМФ в печени. Происходит фосфорилирование и активация ГМГ-КоА синтазы. Аллостерическим ингибитором ГМГ-КоА синтазы выступает сукцинил-КоА.
Обратите внимание: эти реакции происходят в митохондриях. В цитозоле имеются изоферменты, которые также катализируют образование ГМГ-КоА, но в качестве промежуточного продукта в синтезе холестерола.
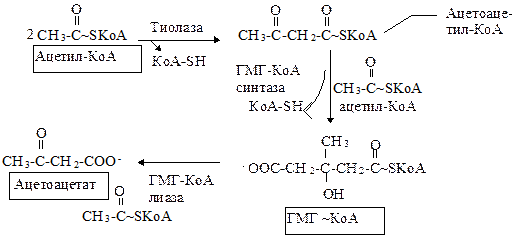
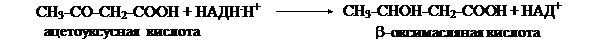 |
Ацетон образуется из ацетоуксусной кислоты при декарбоксилировании:
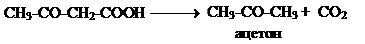 |
Рис. 14.3. Синтез кетоновых тел в митохондриях печени
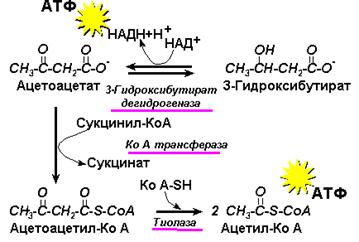
Рис. 14.4. Использование кетоновых тел
Синтез кетоновых тел происходит в печени, но их использование в качестве источников энергии ограничивается только периферическими тканями (рис. 14.4).
Тема 15. СИСТЕМА СВЁРТЫВАНИЯ КРОВИ
Система свёртывания крови по функциональному признаку делится на две системы: свёртывающую (гемокоагуляционную) и противосвёртывающую (антитромботическую). Противосвёртывающее действие обеспечивается антикоагулянтной и фибринолитической системами. Поддержание жидкого состояния циркулирующей крови обеспечивается взаимодействием свёртывающей и противосвёртывающей систем крови, которые в физиологических условиях находятся в динамическом равновесии.
СВЁРТЫВАЮЩАЯ (ГЕМОКОАГУЛЯЦИОННАЯ) СИСТЕМА КРОВИ
Назначение свёртывающей системы крови — образование нерастворимого фибрина. В свёртывающую систему крови входят ферментные и неферментные белки плазмы, тканей и форменных элементов крови (прежде всего тромбоцитов), надмолекулярные образования (фрагменты клеточных мембран) и ионизированный кальций. Международный комитет по выработке номенклатуры факторов свёртывания присвоил арабскую нумерацию тромбоцитарным (P1–11) и римскую (ф.I–XIII) — плазменным и тканевым факторам.
Большинство плазменных факторов гемокоагуляции являются ферментами (сериновые протеиназы), синтезируются в печени и секретируются в кровь в неактивном состоянии, то есть в виде прокоагулянтов. Активирование большинства прокоагулянтов осуществляется путём частичного протеолиза. На определённых этапах процесс свёртывания резко ускоряется неферментными белками (ф.VIII и ф.V), выполняющими роль коферментов.
Свёртывание крови (гемокоагуляция) — цепной каскадный ферментативный процесс, в ходе которого происходит взаимодействие и последовательная активация ряда сериновых протеиназ на фосфолипидных матрицах (тромбопластинах), заканчивающийся превращением растворимого фибриногена в нерастворимый фибрин.
Время свёртывания крови составляет 5–7 мин.
Выделяют три фазы гемокоагуляции и посткоагуляционную фазу.
Первая фаза — образование протромбиназы или активного тромбопластина крови
(4 мин 50 с – 6 мин 50 с).
Вторая фаза — образование тромбина (2–5 с).
Третья фаза — образование фибрина (2–5 с).
Четвертая(посткоагуляционная) фаза — ретракция тромба, то есть образование гемостатически полноценного тромба (55–85 мин).
В зависимости от механизма первой фазы различают внешнюю и внутреннюю системы свёртывания крови (рис. 15.1).
Внутренний путь образования протромбиназы. Во внутреннем пути все необходимые факторы присутствуют в движущейся крови и реакции свёртывания начинаются при контакте крови с измененной или чужеродной поверхностью, по смачиваемости отличающейся от эндотелия (повреждённая сосудистая стенка или измененная вследствие васкулитов, атеросклероза, интоксикации; поврежденный эндокард). Кроме контакта с чужеродной поверхностью активирование фактора ХII может осуществляться ферментом калликреином, а также иммунными комплексами, адреналином, жирными кислотами, холестеролом, триацилглицеролами, эндотоксинами, бактериальными липопротеинами и другими веществами. Во внутренней активирующей системе источник тромбопластинов — плазматические мембраны активированных тромбоцитов (Р3 — тромбоцитарный тромбопластин).
Внешний путь образования протромбиназы. Появление в кровотоке обломков клеточных мембран (ф.IIIа — активный тканевый тромбопластин) при травме и других патологических состояниях или продукция тканевого тромбопластина эндотелиоцитами (при стазе крови, гипоксии, ацидозе, действии протеиназ и токсинов на эндотелий) быстро запускает внешний механизм свертывания крови.
Продукт второй фазы — тромбин. Тромбин — ключевой фермент гемокоагуляции, количество которого строго контролируется.
 Роль витамина «К» в гемокоагуляции. Витамин К (К1, К2, К3, викасол и другие) является антигеморрагическим фактором. Он принимает участие в посттрансляционном созревании факторов II, VII, IX и Х свёртывающей системы крови (а также в созревании витамин К-зависимых антикоагулянтов — протеинов С и S). Гамма-карбоксилирование остатков глутаминовой кислоты в молекуле этих белков протекает после трансляции, в эндоплазматическом ретикулуме гепатоцитов с участием g-глутамилкарбоксилазы. Роль кофактора в составе этого фермента выполняет восстановленная форма витамина К:
Роль витамина «К» в гемокоагуляции. Витамин К (К1, К2, К3, викасол и другие) является антигеморрагическим фактором. Он принимает участие в посттрансляционном созревании факторов II, VII, IX и Х свёртывающей системы крови (а также в созревании витамин К-зависимых антикоагулянтов — протеинов С и S). Гамма-карбоксилирование остатков глутаминовой кислоты в молекуле этих белков протекает после трансляции, в эндоплазматическом ретикулуме гепатоцитов с участием g-глутамилкарбоксилазы. Роль кофактора в составе этого фермента выполняет восстановленная форма витамина К:
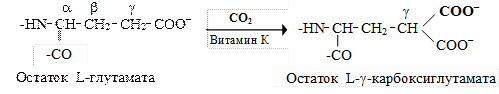
Наличие дополнительной g-карбоксильной группы в остатках глутаминовой кислоты придает этим белкам способность при посредстве ионов кальция связываться на фосфолипидной поверхности и участвовать в реакциях гемокоагуляции. При авитаминозе К содержание витамин К-зависимых факторов системы свёртывания в плазме крови не изменяется, но нарушается их способность связываться на поверхности тромбопластинов.
Длительная и выраженная гиперкоагуляция создает благоприятные условия для тромбообразования.Аномалии или дефицит факторов гемокоагуляции (коагулопатии) ведут к нарушению коагуляционного гемостаза, что сопровождается кровотечениями.
|
Дата добавления: 2014-01-14; Просмотров: 718; Нарушение авторских прав?; Мы поможем в написании вашей работы!