
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция №11. Тема:Электрохимические методы анализа
|
|
|
|
Тема: Электрохимические методы анализа
Цель: сформировать представления об инструментальных методах анализа, основанных на фиксировании электрических параметров исследуемой системы
План лекции: 1)Электрохимическая ячейка, индикаторный электрод и электрод сравнения.
2) Потенциометрия. Электроды потенциометрии
3) Кулонометрия. Закон Фарадея. Электрогравиметрия.
4) Вольтамперометрия
5) Кондуктометрия
Электрохимические методы анализа основаны на измерении и регистрации электрических параметров системы (аналитических сигналов), изменяющихся в результате протекания химических реакций.
Принята следующая классификация этих методов:
1 Классификация, учитывающая природу источника электрической энергии в системе. Здесь различают две группы методов:
– методы без наложения внешнего тока. Здесь источник электрической энергии – сама электрохимическая система (гальванический элемент). К таким методам относятся потенциометрические методы.
– методы с наложением внешнего тока. Здесь химическая реакция в системе начинает протекать при действии внешнего тока (электролитическая ячейка). К ним относятся: кондуктометрия, вольтамперометрия, кулонометрия, электрогравиметрия.
2 Классификация по способу применения. Различают прямые и косвенные методы.
– прямые методы – измеряют аналитический сигнал как функцию концентрации раствора и по показаниям прибора находят содержание вещества в растворе (Прямая потенциометрия, прямая кондуктометрия и т. д.).
– косвенные методы – это методы титрования, в которых окончание титрования фиксируют на основании измерения электрических параметров системы (кондуктометрическое, амперометрическое титрование и т. д.).
|
|
|
Электрохимическая система обычно состоит из электрохимической ячейки, представляющей собой единое конструктивное оформление сосуда с исследуемым раствором и электродами. Электрохимическая ячейка состоит из двух полуэлементов, каждый из которых представляет собой электрод, погруженный в свой электролит (Zn-пластина в растворе ZnSO4, Cu-пластина в растворе CuSO4, устройство см. тему «О-В титрование»). Электроды изготавливают из электропроводящего материала (металла или углерода), реже из полупроводника. Носителями заряда в электродах являются электроны, а в электролите – ионы.
Электрохимические ячейки бывают двух типов: гальванические элементы и электролитические ячейки (электролизеры):
В гальваническом элементе химические реакции протекают самопроизвольно на границе раздела электрод/электролит, а электроды соединены друг с другом проводником. В ГА электрический ток возникает за счет ОВР на электродах.
В электролитической ячейке реакции на границе раздела электрод/электролит протекают за счет внешнего источника электрической энергии; последняя превращается в химическую энергию продуктов реакций, протекающих на электродах. Т.е. химическая реакция на электродах протекает за счет внешней силы тока (следует отметить, что одна и та же ячейка в зависимости от режима работы может вести себя то как гальванический элемент, то как электролизер. Пример: автомобильный аккумулятор действует как гальванический элемент, когда используется для запуска двигателя (при этом он разряжается), и как электролизер, когда заряжается от автомобильного генератора или от зарядного устройства).
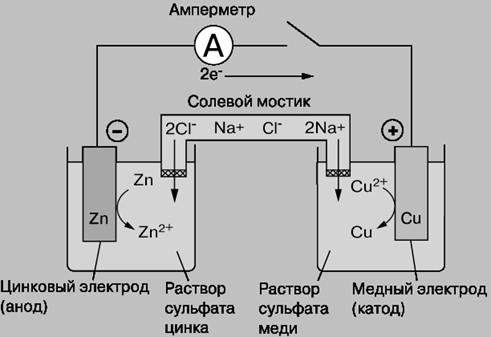
Рис.1 Схема гальванического элемента (Даниель, 1836)
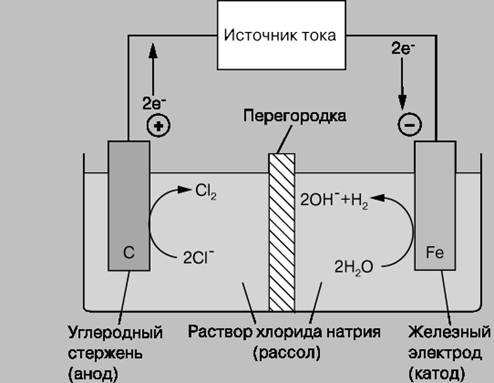
Рис. 2 Электролитическая ячейка
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 1577; Нарушение авторских прав?; Мы поможем в написании вашей работы!