
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диссоциация кислот, оснований и солей в водных растворах
|
|
|
|
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода:
НBr D H+ + Br- 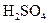 → H+ + Н → H+ + Н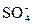
|
Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации.
HBr - одноосновная; H2CO3 - двухосновная; H3PO4 - трехосновная.
Диссоциируют:

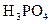 D H+ +
D H+ +  - (1 -я ступень) КIд =
- (1 -я ступень) КIд = 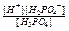 = 7,6·10–3
= 7,6·10–3
 D H+ +
D H+ +  - (2 -я ступень) КIIд =
- (2 -я ступень) КIIд =  =6,2 ·10–8 кислоты по
=6,2 ·10–8 кислоты по
определению
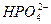 D H+ +
D H+ + 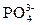 - (3 -я ступень) КIIIд =
- (3 -я ступень) КIIIд = 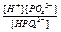 = 4,2·10–13
= 4,2·10–13
| Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-анионы. Основания химических элементов IА группы растворимы в воде и называются щелочами. Это LiOH, NaOH, KOH, RbOH, CsOH. Основания химических элементов IIА группы и NH3 •Н2O называют просто растворимыми в воде гидроксидами или основаниями |
| Кислотность основания определяется числом гидроксогрупп. KOH – однокислотное; Ba(OH)2 - двухкислотное; Al(OH)3 - трехкислотное основание. |
| Амфотерные электролиты при диссоциации образуют одновременно и катионы водорода и гидроксид-анионы (H2O; Al(OH)3; Zn(OH)2, Cr(OH)3 и т.д.) Zn2+ + 2OH- + 2H2O D Zn(OH)2 + 2H2O D 2H+ + [Zn(OH)4]2- |
| Соли – электролиты, при диссоциации которых образуются катионы металлов и анионы кислотного остатка. |
Примеры: CaCl2 → Ca2+ ++ 2Cl- CaOHCl → CaOH+ + Cl-
K3PO4 → 3K+ + PO3-4 KH2PO4 → K+ + H2PO-4
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 1201; Нарушение авторских прав?; Мы поможем в написании вашей работы!