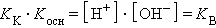КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция №5. Тема:Кислотно-основные свойства химических соединений
|
|
|
|
Тема: Кислотно-основные свойства химических соединений. Теория окислительно-восстановительных реакций
Цель: рассмотреть эволюцию представлений о природе кислот и оснований, основные положения теории ОВР.
План лекции: 1) Современные представления о кислотах и основаниях
2) Основные положения теории Бренстеда-Лоури. Кислотно-основные сопряженные пары
3) Основные положения теории окислительно-восстановительных реакций, методика составления уравнений окислительно-восстановительных реакций.
window.top.document.title = "6.6. Кислотно-основные свойства химических соединений";
Любое вещество в определенных условиях может проявлять свойства кислоты и основания по отношению к какому-либо другому веществу, включая и растворитель.
Со времен Аррениуса, по определению которого кислоты в водных растворах диссоциирует на ионы водорода и анионы, а основания диссоциируют на гидроксид-ионы и катионы, круг веществ, участвующих в реакциях кислотно-основного равновесия, значительно расширился. Общепринятными считаются протонная теория Бренстеда–Лоури и электронная теория Льюиса.
Протонная теория Бренстеда–Лоури применима лишь к протонсодержащим или протонприсоединяющим веществам. Согласно этой теории кислотой называется вещество, способное быть донором протонов, а основанием – вещество, которое может присоединить (акцептировать) протон:

|
По определению, HAn – кислота, An– – основание, сопряженное с этой кислотой. Любой кислоте соответствует сопряженное с ней основание.
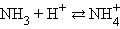
|
Любое кислотно-основное равновесие включает взаимодействие двух пар сопряженных кислот и оснований.
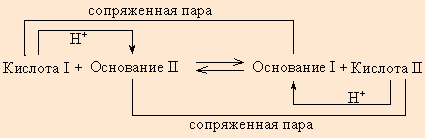 1 1
|
| Рисунок 1. |
В определенных условиях многие вещества могут вести себя как кислота или как основание. Эти два понятия неразделимы, а потому правильнее говорить о кислотно-основных свойствах данного вещества.
|
|
|
В соответствии с законом действующих масс константы равновесия реакций протолиза сопряженных кислот и оснований в воде связаны между собой простым соотношением
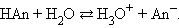
|
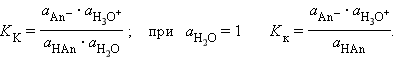
|
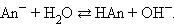
|
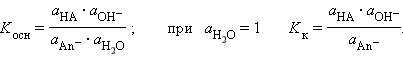
|
Перемножив константы сопряженных кислот и оснований, получим

|
Заменив активности 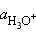 и
и  на равновесные концентрации, получим
на равновесные концентрации, получим
|
Произведения констант диссоциации сопряженных кислот и оснований в водных растворах равно ионному произведению воды. По известным K K(K осн) можно легко найти значения сопряженных K В.
Электронная теория Льюиса допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому ее называют апротонной. Согласно апротонной (электронной) теории, кислотой называется вещество, способное присоединять электронную пару, а основанием – вещество, способное отдавать электронную пару.
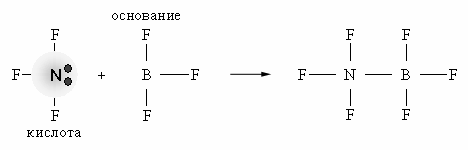
При взаимодействии донора электронной пары: NF3 (кислота) и акцептора электронной пары BF3 (основание) образуется более устойчивое электронное окружение (октет) за счет донорно-акцепторной (двухэлектронной двухцентровой) связи.
 2 2
|
| Рисунок 2. |
Ни кислота, ни основание протонов не содержат.
Эта концепция расширяет границы веществ, проявляющих кислотно-основные свойства, включая в себя протонотдающие и протонприсоединяющие системы.
В периоде сила кислородсодержащей кислоты растет с увеличением заряда и с уменьшением радиуса иона кислотообразующего элемента:

|
Для одного и того же элемента константа диссоциации различных кислот возрастает по мере увеличения степени окисления кислотообразующего элемента примерно на пять порядков каждый раз.
|
|
|
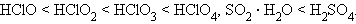
|
В пределах одной группы элементов сила кислоты уменьшается по мере увеличения радиуса кислотообразующего элемента:

|
Для многоосновных кислот способность к депротонизации уменьшается по мере увеличения отрицательного заряда аниона:

|
При этом константа диссоциации каждой последующей ступени уменьшается примерно на пять порядков:
| K 1: K 2: K 3 = 1: 10–5: 10–10. |
Теория окислительно-восстановительных реакций.
Окислительно-восстановительные реакции являются основой жизни на
Земле. С ними связано дыхание и обмен веществ в живых организмах, фотосинтез в зеленых частях растений и нервная деятельность человека и животных. Их можно наблюдать при сгорании топлива, в процессах коррозии металлов и электролиза. С помощью окислительно-восстановительных реакций получают металлы, органические и неорганические соединения, проводят очистку различных веществ, природных и сточных вод и т. п.
Окислительно-восстановительные реакции (ОВР) – это реакции,
протекающие с изменением степени окисления элементов и сопровождающиеся переходом электронов.
Таким образом, любая окислительно-восстановительная реакция представляет собой совокупность процессов окисления и восстановления.
Окисление – это процесс отдачи электронов восстановителем:
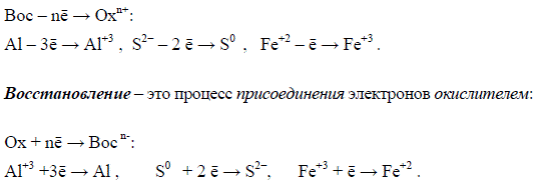
При окислении элемента степень окисления всегда увеличивается, а
при восстановлении – уменьшается.
Частицы (молекулы, атомы, ионы), которые содержат окисляющиеся
атомы, называются восстановителями.
Частицы (молекулы, атомы, ионы), которые содержат восстанавливающиеся атомы, называются окислителями.
В общем виде окислительно-восстановительную реакцию можно записать следующим образом:

Из приведенных полуреакций видно, что окислитель превращается в
сопряженный восстановитель (продукт восстановления окислителя), а восстановитель – в сопряженный окислитель (продукт окисления восстановителя), образуя окислительно-восстановительную пару. Например, в реакции
HCl+1O + H2S2– = HCl–1 + S0↓ + H2O
окислитель – хлорноватистая кислота HCl+1O, которая восстанавливается до
|
|
|
Cl−1: Cl+1 + 2 ē → Cl−, а восстановитель – сероводород H2S, в котором сульфид-ион S2− окисляется до S0: S2− – 2 ē → S0.
Окислитель (HClO) образует окислительно-восстановительную пару
HClO/ Cl−, где HClO – окисленная форма, а Cl− – восстановленная форма.
Соответственно окислительно-восстановительная пара восстановителя (H2S)
S/H2S, где S – окисленная форма, а H2S – восстановленная форма.Для характеристики состояния элемента в молекуле введено понятие степени окисления.
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 911; Нарушение авторских прав?; Мы поможем в написании вашей работы!