
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз
Электролизом называется совокупность процессов, протекающих при прохождении постоянного электрического тока через систему, состоящую из двух электродов и расплава или раствора электролита. Эти процессы складываются из направленного движения ионов в растворе или расплаве электролита и реакций восстановления и окисления, происходящих на электродах
Электрод, на котором протекают процессы окисления, называется анодом, а электрод, на котором протекают процессы восстановления – катодом.
Потенциал анода всегда меньше потенциала катода. При электролизе анод заряжен положительно, катод – отрицательно.
При электролизе растворов электролитов на катоде возможны следующие реакции:
1) восстановление ионов металла Men+ + nē → Me;
2) восстановление ионов водорода в кислой среде
2Н+ + 2ē → Н2 (φ0 (2Н+/Н2) = 0,0 В);
3) восстановление молекул воды
2Н2О + 2ē → Н2 + 2ОН- (φ0 (Н2О/Н2) = -0,41 В).
Из возможных катодных процессов осуществляется тот, который характеризуется наибольшим значением электродного потенциала.
Из этого следует, что при электролизе растворов солей металлов, стоящих в ряду напряжения после водорода, например, медь, серебро, золото и другие, на электроде восстанавливаются только ионы металла и выделяется металл. В нейтральных и щелочных растворах с рН ≥ 7 возможно выделение и тех металлов, электродные потенциалы которых выше -0,41 В. (Объяснение следует дальше)
Из растворов, содержащих смесь таких катионов, происходит последовательное выделение металлов в порядке уменьшения величины их электродных потенциалов.
Если в растворе находятся ионы металлов, стоящие в ряду напряжения до алюминия включительно (φ0 (Аl3+/Al) = -1.66 В), например, натрий, литий, кальций и другие, то на катоде восстанавливается только вода.
Металлы, электродные потенциалы которых не сильно отличаются от водородного (находится в ряду напряжения металлов после алюминия), восстанавливаются на катоде одновременно с водой. При этом выделяется и металл, и водород. В зависимости от условий электролиза массовые соотношения металла и водорода могут быть различными, вплоть до выделения только одного металла или водорода.
При электролизе растворов электролитов на аноде могут протекать реакции окисления:
1) анионов кислотных остатков: Ann- →An + nē;
2) гидроксид - анионов
4ОН- - 4ē →2Н2О + О2 (φ0 (O2 + 2Н2O/4OH-) = 0,4 B);
3) молекул воды
2Н2О - 4ē → О2 + 4Н+ (φ0 (O2 + 4Н+/2Н2O) = 1,23 B при рН = 7);
4) металла анода (растворимый анод)
Me →Men+ + nē.
Из возможных анодных процессов осуществляется тот, который характеризуется наименьшим значением электродного потенциала.
Характер анодных процессов зависит от природы используемого анода. Различают инертные и растворимые аноды. Первые изготовлены из малоактивных металлов, например, из платины, а также используют графитовые, угольные электроды. Материалом растворимых анодов является металл с потенциалом меньшим, чем потенциалы конкурирующих процессов, например, медь, цинк и другие. При этом окислению подвергается материал анода. Так, при электролизе раствора сульфата меди (II) с медным анодом происходит растворение анода: Сu → Cu2+ + 2ē. Это объясняется тем, что потенциал меди (φ0(Cu2+/Cu) = 0,34 B) меньше потенциалов окисления воды и сульфат - иона. В процессе электролиза с использованием растворимого анода металла анода в виде ионов переходит в раствор, затем они могут восстанавливаться на катоде. На этом основаны методы очистки металлов от примесей (электрохимическое рафинирование металлов), методы нанесения покрытий и прочее.
На инертных анодах (графитовый, угольный, платиновый) могут окисляться молекулы воды, гидроксид – ионы или ионы кислотных остатков.
На аноде в растворах кислородосодержащих кислот или их солей разряжается вода. Это связано с тем, что электродные потенциалы анионов кислородосодержащих кислот имеют большие значения, чем потенциал окисления воды. Например, 2SO42- - 2ē → S2O82- (2,01 В). Аналогично ведут себя фторид-ионы (φ0(F2/2F-) = 2,87 B).
Ионы Cl-, Br-, J-, S2- разряжаются из не очень сильно разбавленных растворов.
2Сl- → Cl2 + 2ē, φ0(Cl2/2Cl-) = 1,36 B,
2Br- → Br2 + 2ē, φ0(Br2/2Br-) = 1,065 B,
2J- → J2 + 2ē, φ0(J2/2J-) = 0,54 B,
S2- → S + 2ē, φ0(S/S2-) = -0,51 B,
В связи с перенапряжением реакции выделения кислорода на аноде идёт окисление ионов хлора, хотя его потенциал больше потенциала окисления воды.
При электролизе растворов щелочей на аноде происходит окисление гидроксид-ионов, т.к. этот процесс характеризуется наименьшим потенциалом.
ПРИМЕР 1: Составьте схемы электролиза раствора NiCl2 (анод угольный).
ОТВЕТ: На катоде могут разряжаться вода и катионы никеля. Т. к. величина потенциала никеля (φ0(Ni2+/Ni) = -0,25 В) близка к значению потенциалу восстановления воды, на катоде будут восстанавливаться и ионы металла, и вода. Конкурирующими анодными реакциями являются окисление воды и окисление хлорид – иона, на аноде окисляется ион хлора (объяснение смотрите выше).
Схема электролиза раствора NiCl2
(-) Катод: (+) Анод:
 Ni2+ + 2ē → Ni 2Cl- -2ē → Cl2
Ni2+ + 2ē → Ni 2Cl- -2ē → Cl2
2Н2О + 2ē → Н2 + 2ОН-
Ni2+
Общая реакция электролиза хлорида никеля (II) –
2NiCl2 + 2Н2О → Ni + Ni(OH)2 + H2 + 2Cl2
ПРИМЕР 2: В чём состоит различие процессов электролитического разложения раствора сульфата меди на угольном и медном анодах?
ОТВЕТ: На катоде могут разряжаться вода и катионы меди. Так как потенциал восстановления катионов меди (II) больше потенциала восстановления воды, восстанавливаться будут ионы меди.
Конкурирующими анодными реакциями (угольный анод) являются окисление воды и окисление сульфат – иона.
Так как φ0 (S 2O82-/2SO42-) > φ0 (O2 + 4Н+/2Н2O), следовательно, на аноде окисляется вода.
Схема электролиза раствора CuSO4 на угольном аноде
(-) Катод: (+) Анод:
 Сu2+ + 2ē → Cu 2Н2О - 4ē → О2 + 4Н+
Сu2+ + 2ē → Cu 2Н2О - 4ē → О2 + 4Н+
2SO42-
При использовании медного анода окислению подвергается материал анода - медь, в результате чего анод будет растворяться.
Схема электролиза раствора CuSO4 на медном аноде
 (-) Катод: (+) Анод:
(-) Катод: (+) Анод:
Сu2+ + 2ē → Cu Сu - 2ē → Cu2+
SO42-
Следовательно, электролиз растворов сульфата меди (II) на угольном и растворимом аноде отличаются анодными процессами. При электролизе на инертном аноде окисляется вода, образуя кислород и кислоту, в случае растворимого анода данные процессы происходить не будут.
Процессы, протекающие при электролизе, подчиняются законам Фарадея.
I. Масса электролита, подвергшаяся превращению при электролизе, а также массы образующихся веществ прямо пропорциональны количеству электричества, прошедшего через электролит.
m = k ∙ q
где m - масса (г) образовавшегося, или подвергшегося превращению вещества;
q – количество электричества, прошедшего через электролит (Кл),
q = J ∙ t,
где J – сила тока, А; t – время, с.
k – электрохимический эквивалент.
Электрохимический эквивалент численно равен массе вещества, выделяемого 1 Кл электричества.
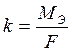
где МЭ – молярная масса эквивалента, г/моль-экв;
F – постоянная Фарадея, равная 96500 Кл.
Постоянная Фарадея – это количество электричества, необходимое для осуществления электрохимического превращения одного моль эквивалента вещества.
Подставив все параметры, получим выражение:
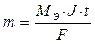
II. При электролизе различных электролитов равные количества электричества выделяют на электродах массы веществ, пропорциональные их эквивалентным массам.
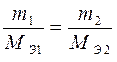
ПРИМЕР 3: Рассчитайте массы веществ, образовавшихся на электродах при электролизе раствора сульфата меди (II) (на инертном аноде) при пропускании тока силой 10 А в течение 30 минут.
ОТВЕТ: Схема электролиза раствора сульфата меди (II) на угольном аноде рассмотрена в примере 4. Суммарное уравнение электролиза раствора CuSO4:
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4.
На катоде образуется медь, на аноде – кислород. Для определения масс меди и кислорода воспользуемся первым законом Фарадея.
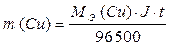 ;
; 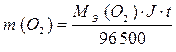
MЭ (Cu) = 63,55/2 = 31,78 г/моль-экв
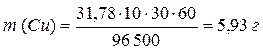
MЭ (О2) = 32/4 = 8 г/моль-экв
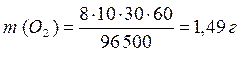 .
.
ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ
121. Составьте схемы электролиза растворов веществ (на угольных анодах): K2SO4; NiCl2. При электролизе какого из предложенных вам веществ выделяется кислород? Сколько кислорода выделится при электролизе током силой 30 А в течение 1,5 часов?
122. Составьте схемы электролиза растворов веществ (на угольных анодах): NaOH; AgNO3. При электролизе, какого из предложенных вам веществ выделяется водород? Сколько водорода выделится при электролизе током силой 25 А в течение одних суток?
123. Составьте схемы электролиза растворов веществ (на угольных анодах): H2SO4; CaCl2. Сколько грамм серной кислоты подвергнется электролитическому разложению в течение 20 мин под действием тока силой 120 А?
124. Составьте схемы электролиза растворов веществ (на угольных анодах): NaNO3; SnCl2. Какое соединение образуется на катоде при электролизе нитрата натрия? Найдите его массу, если электролиз протекал 2 часа с силой тока 100 А.
125. Составьте схемы электролиза растворов веществ (на угольных анодах): CuSO4; FeCl2. Сколько грамм меди выделится на электроде при пропускании через раствор электролита заряда 241,25 Кл?
126. Составьте схемы электролиза растворов веществ (на угольных анодах): HCl; Cr(NO3)2. Рассчитайте силу тока, который выделит 50 г водорода из раствора HCl в течение 20 мин.
127. Составьте схемы электролиза растворов веществ (на угольных анодах): KOH; CuCl2. Найдите силу тока, с которой проводят электролиз раствора CuCl2, массой 16,79 г, в течение 20 мин.
128. Составьте схемы электролиза растворов веществ (на угольных анодах): AgNO3; CoCl2. Определите массу серебра, выделившегося на катоде при пропускании через раствор нитрата серебра тока силой 50 А в течение 50 мин.
129. Составьте схемы электролиза растворов веществ (на угольных анодах): BeCl2; CdSO4. Рассчитайте электрохимический эквивалент хлорида бериллия.
130. Составьте схемы электролиза растворов веществ (на угольных анодах): HNO3; CuBr2. При электролизе какого из предложенных вам соединений образуется водород? Определите объём водорода, если электролитическое разложение проводят током силой 200 А в течение 2 часов.
131. Составьте схемы электролиза растворов веществ (на угольных анодах): Ca(OH)2; NiCl2. Какое количество электричества необходимо для электрохимического превращения 34 г гидроксида кальция?
132. Составьте схемы электролиза растворов веществ (на угольных анодах): PtCl2; Sn(NO3)2. Как долго нужно проводить электролиз для получения 19,5 г платины, если сила тока составляет 120 А?
133. Составьте схемы электролиза растворов веществ (на угольных анодах): CuCl2; FeSO4. В течение какого времени осуществляется электролитическое разложение 38 г хлорида меди, содержащихся в растворе? Сила тока равна 65 А.
134. Составьте схемы электролиза растворов веществ (на угольных анодах): Ba(OH)2; NaCl. При электролизе какого из предложенных вам соединений образуется кислород? Определите объём кислорода, если электролитическое разложение проводят током силой 40 А в течение 1 часа.
135. Составьте схемы электролиза растворов веществ (на угольных анодах): MnBr2; Ni(NO3)2. Определите электрохимические эквиваленты веществ, образующихся на катоде при электролизе нитрата никеля(II).
136. Cоставьте схемы электролизов раствора AgNO3, протекающих на угольном и растворимом серебряном анодах. В чём будет заключаться различие? Определите массу серебра, выделившегося на катоде при пропускании тока силой 100 А в течение 30 мин через раствор AgNO3?
137. Cоставьте схемы электролиза растворов Zn(NO3)2, протекающих на угольном и растворимом цинковом анодах. В чём будет заключаться различие? Определите объём газа выделившегося на катоде при пропускании тока силой 50 А в течение 10 мин через раствор Zn(NO3)2?
138. Cоставьте схемы электролиза растворов NiCl2, протекающих на угольном и растворимом никелевом анодах. В чём будет заключаться различие? Какой заряд нужно пропустить через раствор хлорида никеля (угольный анод), чтобы подвергнуть превращению 0,325г хлорида никеля?
139. Cоставьте схемы электролиза растворов Ti(NO3)2, протекающих на угольном и растворимом титановом анодах. В чём будет заключаться различие? Определите силу тока, пропускаемого через раствор Ti(NO3)2 в течение 20 мин, если объём газа, выделившегося на аноде, составляет 2,79 л (угольный анод)?
140. Cоставьте схемы электролиза растворов CoCl2, протекающих на угольном и растворимом кобальтовом анодах. В чём будет заключаться различие? Рассчитайте электрохимический эквивалент выделившегося на аноде продукта (электролиз проводят на угольном аноде).
|
|
Дата добавления: 2014-11-06; Просмотров: 7658; Нарушение авторских прав?; Мы поможем в написании вашей работы!