
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Работа 20. Обнаружение оксидоредуктаз в биологическом материале
|
|
|
|
Выявление ферментов, относящихся к разным классам
Все ферменты в зависимости от типа катализируемых химических реакций делятся на шесть классов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы (синтетазы). Внутри каждого класса ферменты подразделяются на подклассы, подподклассы, которые уточняют природу ферментативной реакции (номенклатуру и систему нумерации ферментов см. учебник, с.125-129).
Для обнаружения ферментов каждого класса в биологическом материале имеются свои особенности, поэтому необходимо определить условия для протекания ферментативной реакции. Качественные реакции на ферменты используются в клинике для обнаружения ферментов в мазках крови, биоптатах и микропрепаратах при энзимоцитохимических исследованиях, а также в гигиенической практике при постановке проб на присутствие ферментов в продуктах питания (молоко, картофель и т.д.). При разделении ферментов методом электрофореза их идентификацию также производят с помощью качественных реакций.
В реакциях, катализируемых оксидоредуктазами, окисляемый субстрат рассматривается как донор водорода или электронов, а акцептором могут быть природные вещества (коферменты – НАД, НАДФ, ФМН, ФАД, КоQ, кислород, органические соединения, цитохромы и др.) и ксенобиотики.
Для большинства ферментов этого класса рекомендуются названия: дегидрогеназы и редуктазы. В тех случаях, когда акцептором служит О2, используется термин оксидаза, а если кислород в ходе реакции включается в состав субстрата, то фермент называется оксигеназа. Пероксидаза является ферментом, использующим Н2О2 в качестве акцептора, а каталаза – ферментом, катализирующим реакции, где донорно- акцепторную пару составляют две молекулы Н2О2.
|
|
|
Реактивы. Формальдегид, 0,4%-ный раствор; метиленовый синий, 0,01%-ный раствор.
Оборудование. Штатив с пробирками; водяная баня; лабораторный термометр; пипетки вместимостью 1 и 5 мл.
Материал.
1. Картофельный сок (сырой картофель натирают на терке и отжимают через два слоя марли).
2. Свежее коровье молоко.
а. Выявление альдегидоксидазы (альдегид: кислород оксиредуктаза; КФ 1.2.3.1) в молоке. Метод основан на визуальном наблюдении за обесцвечиванием метиленового синего (МС), связывающего водород, который отщепляется с участием альдегидоксидазы от субстрата.
Альдегидоксидаза катализирует реакцию дегидрирования различных альдегидов, например, формальдегида. Водород переносится на ФАД+, являющийся коферментом данного фермента, а затем на конечный акцептор – кислород – по уравнению
Альдегидоксидаза
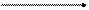 НС ═ О + Н2О + ФАД+ Н ─ С ═ О + ФАД∙Н2
НС ═ О + Н2О + ФАД+ Н ─ С ═ О + ФАД∙Н2
│ │
Н ОН
Альдегидоксидаза
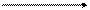 ФАД∙Н2 + О2 ФАД+ + Н2О2
ФАД∙Н2 + О2 ФАД+ + Н2О2
При добавлении МС – искусственного акцептора водорода – в бескислородных условиях образуется его восстановленная форма (лейкоформа) МС∙Н2:
Альдегидоксидаза

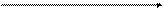 Н ─ С ═ О + Н2О Н ─ С ═ О
Н ─ С ═ О + Н2О Н ─ С ═ О
 │ │
│ │
Н ФАД+ ФАД∙Н2 ОН

МС∙Н2 МС
(лейкоформа) (синее окрашивание)
Если бесцветный раствор метиленового синего встряхнуть, то он вновь приобретет синюю окраску:
МС∙Н2 + О2 → МС + Н2О2
Ход определения. В две пробирки вносят по 5 мл свежего молока и добавляют в первую 1 мл воды, а во вторую такой же объем раствора формальдегида. В обе пробы приливают по 1 мл раствора метиленового синего, содержимое перемешивают и приливают 3-4 капли вазелинового масла (для предохранения жидкой смеси от контакта с кислородом воздуха).
Пробирки ставят в водяную баню, нагретую до 37˚С. Через 5-10 мин сравнивают изменение окрашивания в пробах. Сильно встряхнув, вновь отмечают переход окраски.
|
|
|
б. Выявление пероксидазы (донор: Н2О2 оксидоредуктаза; КФ 1.11.1.7) в картофеле и в молоке. В основе метода лежит реакция с бензидином (см. работу 9, а).
Ход определения. В две пробирки наливают по 1 мл соответственно сырого молока и картофельного сока. Добавляют в обе пробы по 5 капель спиртового раствора бензидина и по капле раствора пероксида водорода. Отмечают характерное окрашивание.
Оформление работы. Результаты занести в таблицу и отметить характерное окрашивание индикатора реакции.
| Материал | Выявленный фермент | Субстрат (донор) | Акцептор | Индикатор реакции | Результат |
В выводах указать на присутствие в биологическом материале изучаемых ферментов и практическое значение работы.
Работа 21. Обнаружение холинэстеразы
(ацетилхолинацилгидролаза; КФ 3.1.1.7)
в сыворотке крови экспресс-методом Херцфельда и Штумпфа
Реактивы. Полоски фильтровальной бумаги, смоченные субстратно-индикаторным раствором (0,2 г ацетилхолина-бромида и 0,1 г дибромсульфофталеина растворить в 7 мл 96%-ного этанола).
Оборудование. Предметные стекла; пинцеты; микропипетки; часы; водяная баня.
Материал. Сыворотка крови.
Метод основан на изменении окраски индикатора дибромсульфофталеина (от синей до зеленой и желтой), происходящем в результате освобождения уксусной кислоты при гидролизе ацетилхолина холинэстеразой:
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 1415; Нарушение авторских прав?; Мы поможем в написании вашей работы!