
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хронокондуктометрия 19 страница
|
|
|
|
Электр мөлшерін не кулонометр, не графиктік интегралдау тәсілімен анықтағаннан кейін осы формула арқылы түзілген зат салмағын анықтайды.
Q = z Іdt теңдеуінен, электролизді шексіз уақыт жүргізгенде токтың (І) теориялық мәні нольге ұмтылатынын байқауға болады. Шындығында, электролиз шексіз уақытқа созылғанда ток күші белгілі бір төменгі мәнге жеткенде онан әрі азаюын тоқтатып, тұрақты болып қалады. Бұл ток қалдық ток деп аталады, ол әр түрлі қоспалардың - деполяризаторлардың электрод реакцияларына қатысуынан туындайды. Сондықтан электролиздің аяқталуы деп, ток күші біраз уақыт ішінде өзгеріссіз қалған мезетті айтуға болады.
Бақыланатын тұрақты потенциал кезіндегі әдіс, төмен концентрациялы электроактивті заттарды анықтауда жиі қолданылады. Тура кулонометриялық анализді, сондай-ақ бақыланатын электролиз тогында – (І=const, тура гальваностатикалық кулонометрия, ТГК) жүргізуге болады.
Жанама кулонометриялық әдіспен анықтау әдісі электрохимиялық және химиялық реакциялардан құралатын болса, ал тура кулонометриялық анықтау әдісінде тек электрохимиялық реакциялар пайдаланылады.
Кулонометриялық анализді жүргізу үшін потенциостат немесе гальваностат, кулонометр (ток интеграторы), жұмысшы және салыстырмалы электродтары бар электрохимиялық ұяшық қажет.
Потенциостаттың негізгі қызметі – потенциалды тұрақты ұстап тұру, ал гальваностаттың қызметі – жұмысшы электродындағы поляризациялық токтың мәнін берілген деңгейде, электрохимиялық ұяшықтағы процестердің өзгерістеріне тәуелсіз тұрақты ұстап тұру болып табылады. Қазіргі кезде потенциостаттар мен гальваностаттар түрлері алуан түрлі. Потенциостат, салыстыру электроды бойынша жұмысшы электродқа берілген потенциалды электрод бетінде жүретін электрохимиялық немесе химиялық реакцияларға және анализденетін электролит ерітіндісіне тәуелсіз, поляризациялаушы токты өзгерту арқылы тұрақты ұстап тұрады. Гальваностат, электролиз тізбегіндегі токты қажетті мәнде тұрақты ұстап тұруы үшін ұяшыққа жоғары омдық кедергі тізбектеле жалғанады, нәтижесінде электродтарға берілген кернеу өзгеріп отырады.
|
|
|
Қазіргі таңда потенциостаттардың түрлері өте көп және жан-жақты жетілдірілген, олар гальваностат ретінде де жұмыс жасай алады. Сондай-ақ қазіргі кезде потенциостаттық режимнен жылдам гальваностаттық режимге және керісінше ауыса алатын электронды қондырғылар бар.
СВА -1В, П-5827 және П-5827М сериялы потенциостаттар әлі күнге дейін кеңінен қолданылып келеді. Бұл потенциостаттар, электролит ерітіндісінде өтетін анодтық және катодтық процестерді зерттеуге қажетті электрохимиялық реакциялардың поляризациялық қисықтарын потенциодинамикалық және гальваностатикалық режимде түсіруге мүмкіндік береді. Таза заттар алуда, металдар мен құймалардың коррозиялық қасиеттерін сынауда және құймалар мен ерітінділердің анализінде және т.б. мақсаттарда жүргізілетін түрлі электрохимиялық процестердің жүру жағдайын потенциостатта поляризациялық қисықтар түсіре отырып, реттеуге болады. Қосымша жабдықтаулармен жабдықталған потенциостаттар - жұмысшы электродына берілген потенциалды ұстап тұруды, жұмысшы электродының потенциалын немесе тогын сатылап және сызықты заңдылықпен әр түрлі жылдамдықпен өзгертуді, жұмысшы электродына берілген поляризациялық токты ұстап тұруды, жұмысшы электродының потенциалын немесе поляризациялық тогын сырттай берілетін генератор кернеуіне сәйкес өзгертуді, жұмысшы электродының потенциалын және поляризациялық тогын тіркеу процестерін қамтамасыз етеді.
|
|
|
Кулонометриялық анализде қолданылатын электродтардың бірі - қажетті электрохимиялық реакция жүретін жұмысшы (генераторлық) электрод, ал екіншісі – көмекші электроды. Мұнан басқа, потенциостаттық кулонометрияда салыстыру электроды қолданылады, ол арқылы жұмысшы электродтың потенциалы салыстырмалы түрде бақыланады.
Жұмысшы электродтардың материалдары ретінде - платина, алтын, күміс, сынап, амальгаммалар, графит және сонымен қатар кейде вольфрам, мыс, қорғасын, хром және т.б, қолданылады. Бұлардың ішінде ең жиі қолданылатыны – платина мен сынап, мысалы, платина - анодтық процестер үшін аса тиімді электрод. Сондай-ақ платина электродындағы сутегінің аса кернеулігі өте төмен. Сынап электродында сутегінің аса кернеулігінің үлкен болуына байланысты, онда барлық дерлік катодтық процестерді жүзеге асыруға болады. Бірақ, сынапты анод электроды ретінде қолдануға болмайды, себебі ол оңай ериді. Осылайша бұл екі электрод бір-бірін толықтыра түседі.
Алтын электродының электрохимиялық қасиеттері платинаға ұқсайды. Күміс электроды галогенидтерді және тағы басқа аниондарды анықтауда қажетті Ag+ иондарын генерациялау үшін қолданылады. Түзілген Ag+ иондары анықталынатын аниондармен нашар еритін немесе комплексті қосылыстар түзеді.
Графит электроды едәуір терісірек потенциалдарда жұмыс істеуге мүмкіндік бергенімен, кеуекті болатындықтан ерітіндідегі заттарды оңай адсорбциялайды, бұл анализ нәтижесіне әсерін тигізеді. Дегенмен, тиісті өңдеуден өткізу арқылы (смоламен, парафинмен қанықтыру) графитті өте пайдалы жұмысшы, сондай-ақ индикаторлық электрод ретінде қолдануға болады.
|
|
|
Көмекші электроды ретінде негізінен, қымбат металдан, көбінесе платинадан, күмістен жасалған электродтар қолданылады. Бұл көмекші электродын жұмысшы электродымен бірге, бір камераға орналастыруға мүмкіндік береді.
Салыстыру электроды поляризацияланбайтын, яғни олардан ток өткенде потенциал мәнін тұрақты етіп ұстайтын болуы керек. Көбінесе мұндай мақсатта қаныққан каломельді электроды үлкен табыстармен қолданылып жүр.
Кулонометриялық әдісте электрохимиялық, электрогравиметриялық, титрациялы, газды, колориметриялық және кулонометриялық тәрізді әртүрлі типті кулонометрлер қолданылады.
Электрохимиялық кулонометрлер, бұл 100%-тік ток бойынша шығыммен ерітіндіде түзілген немесе электродтарда бөлінген өнім мөлшерін анықтайтын электролизер. Түзілген электрохимиялық өнімдердің салмағы бойынша кулонометрден өткен және электрлік өзгеріске ұшырағын заттың салмағына сәйкес келетін электр мөлшерін Q есептейді.
Электрогравиметриялық кулонометрлер электролит құрамына тәуелді - мыс, күміс галогениді және тағы басқадай да болып келеді. Мыс кулонометрінде мыс электродтары және электролит ретінде күкірт қышқылды ортадағы мыс сульфатының ерітіндісі пайдаланылады.
Бақылау сұрақтары:
1. Кулонометриялық титрлеу ұяшығы.
2. Электродтар мен оларға қойылатын талаптар.
3. Кулонометриялық титрлеу қисығының титрлеу соңғы нүктесі.
4. Генератор электродында жүретін процестер.
5. Кулонометрлік титрлеу әдісінің ерекшеліктері.
|
|
|
Пайдаланған әдебиеттер:
31. Алексеев В.Н. Количественный анализ М.: Химия, 1974
32. Воскресенский А.Г., Семиколенов Г.Ф., Солодкин И.С. Сборник задач и упражнении по аналитической химии. М.: Высшая школа, 1985.
33. Дорохова Е.Н., Прохова Г. В. Аналитическая химия. Физико –химические методы анализа. М.: Высшая школа, 1991
34. Захарова Э.А. Обработка результатов химического анализа. Томск.: Изв-во Томск. Уни-та, 1984
35. Крешков А.П. Основы аналитической химии. М.: Химия, 1971, т. 1,2.
36. Логинов Н. Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. М.: Химия, 1979.
37. Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1989.
38. Пономарев В.Д. Аналитическая химия 2ч. М.: Высшая школа, 1982
39. Фритц Дж., Шенк Г. Количественный анализ М.: Высшая школа, 1978
40. Чарыков А.К. Математическая обработка результатов химического анализа. Методы обноружения и оценок ошибок. Л.: Химия, 1984
41. Ярославцев А.А. Сборник задач и упражнений по аналитической химии. М.: Высшая школа, 1979
№ 9-10 Лекцияның тақырыбы: Электрохимиялық реакцияның соңғы нүктесін табу
Сабақтың жоспары:
1. Әдістің теориялық негізі
2. Тұрақты электрод потенциалын-дағы кулонометрия
Сабақтың мақсаты:
Кулонометриялық титрлеу қондырғысының конструкциясымен танысып, генератор электродында синтезделінген электроактивті титранттар арқылы ерітінділер концентрациясын анықтау тәсілімен танысу.
Тура потенциостаттық кулонометрия (ТПК) кезіндегі электрлік активті анықталынатын зат қатысында жүретін электрохимиялық реакцияның соңғы нүктесін анықтаудың маңызы өте үлкен. Бұл үшін деполяризатор қатысынсыз анықталынатын ерітіндіде поляризациялық қисық түсіріп, фонды токтың мөлшерін (іф) табады. Осыдан кейін зерттелінетін ерітіндіде тізбектегі ток іф мәніне жеткенше электролиз жүргізеді. Егер токтың мәні іф мәніне дейін төмендемей, қайта одан біршама жоғары болатын болса, онда электролизді әрмен қарай жүргізе береді. Электролизді ток өзгерісі уақыт бірлігінде тұрақты болып сақталған жағдайда, яғни DІ/Dt тұрақты болғанда тоқтатады.
Сондай-ақ, электрохимиялық реакцияның аяқталғанын білу үшін деполяризаторларға арналған индикаторлық реакцияны пайдалануға болады, мұндай жағдайда индикатор спецификалық болып, электродтық реакцияға қатыспауы шарт. Дегенмен, көпшілік жағдайда индикаторлар электрактивті және органикалық қосылыстар болғандықтан, олар жұмысшы электродында жиі адсорбцияланып, оның жұмыс істеу тәртібін бұзады.
Электрохимиялық реакцияның соңғы нүктесін индикациялауды электрохимиялық әдіс бойынша да анықтауға болады. Мысалы, индикаторлық электродтың потенциалы электрохимиялық реакцияның соңғы нүктесінде біршама мәнге күрт секіреді, бұл аралас шекті потенциал деп аталады.
Кулонометриялық анализ кезінде жүзеге асатын электрохимиялық процестің аяқталу дәрежесін бағалау үшін Еж.э. потенциалын салыстыру электроды бойынша бақылайды.
Кулонометриялық анализ әдісінің түрлері
Соңғы жылдары кулонометрияның жаңа жетілдірілген түрлері пайда болды: дифференциалды кулонометрия, субстехиометриялық (инверсиялық) кулонометрия, хронокулонометрия, кулонопотенциография, кулоностати-калық және импульсті гальваностатикалық кулонометрия және т.б. Бұл әдістер негізінен аналитикалық сипаттамаларды жақсартуды қамтамасыз етеді, мысалы, анықтау қателігі мен анализдің ұзаққа созылуын азайтады.
Кулонометрия әдісін жетілдіруге және дамытуға арналған ғалымдардың еңбектері бұл әдістің сандық анықтауларда кеңінен қолдануға болатындығын көрсетеді. Сондай-ақ кулонометриялық анализ бойынша бірқатар бейорганикалық заттардың анықталу әдістемелері жетілдірілген. Мысалы, бұл әдіспен - сурьма, сілтілік және сілтілік-жер металдары, мышьяк, висмут, кадмий, хром, кобальт, мыс, галогенидтер, индий, иридий, родий, темір, қорғасын, марганец, молибден, никель, ниобий, осмий, платина, палладий, плутоний, полоний, сирек жер металдары, рений, рутений, күміс, селен, теллур, галлий, алтын, қалайы, вольфрам, ваннадий, мырыш анықталынады.
Кулонометриялық титрлеу
Кулонометриялық титрлеу әдісін жүргізгенде электродтық реакция кезінде зат-реагент түзіледі, ол сол мезетте-ақ ерітіндіде анықталынатын затпен жылдам әрекеттеседі. Ток күші үнемі тұрақты етіліп ұсталады, сондықтан, ерітіндідегі реагент те сондай тұрақты жылдамдықпен түзіліп отырады. Бұл, кулонометрияның титриметриялық әдістен айырмашылығын көрсетеді, себебі титриметриялық анализде титрлеуші реагент бюреткадан құйылатын болса, ал мұнда бұл реагент, электродта жүретін электродтық реакциялар нәтижесінде пайда болады. Көлемдік анализдердегі сияқты, кулонометриялық титрлеу әдісінде де эквиваленттік нүкте анықталынады. Эквиваленттік нүктені табу, ерітіндінің жарық сіңіргіштік қасиетін өлшеу немесе басқа да сәйкес физикалық мәндерін өлшеу арқылы жүзеге асырылады. Эквиваленттік нүкте көбінесе потенциометриялық, амперометриялық, спектрометриялық әдістермен, кей жағдайда индикатор көмегімен анықталынады. Электролиз аяқталғаннан кейін, кулонометр бойынша тізбектен өткен электр мөлшері арқылы титрлеуге жұмсалған реагент мөлшерін анықтайды.
22.1-суретте кулонометриялық титрлеу әдісіне арналған қондырғының принципиальды схемасы көрсетілген. Қондырғы генерациялық және индикациялық тізбектер бойынша тұрады.
Электролиз кезіндегі қажетті токты алу үшін кернеулігі 220 В болатын айнымалы токты түзеткіштен өткізіп, универсал ток көзі УИП-1, УИП-2 немесе басқа аспаптардың көмегімен генерациялық тізбекке реостат тізбектеле жалғанады. Электролиз тогының тұрақтылығы мен шамасын тізбекке кезектестіріле жалғанған миллиамперметр арқылы бақылап отырады. Тізбекті ауыспалы кілт көмегімен тұйықтайды. Осымен бірмезгілде тізбектің электрохронометрмен тұйықталуы қатар жүреді. Электрохронометр болмаған жағдайда титранттың генерациялану уақытын секундомермен анықтайды. Генерациялық тізбек пен секундомерді бірмезгілде қосады.
Ауыспалы кілт екі жағдайға есептелген: І-ші жағдайда электролиттік ұяшық тізбегін қосады; ІІ-ші жағдайда – потенциометрдің тізбегіне қосылып тұйықталады. Потенциометр генерация тізбегіндегі токтың тұрақтылығын (ұяшықты ажыратқанда) сақтайды.
Кулонометриялық тирлеу үшін кеңістіктері бөлінген екі камерадан тұратын шыны ұяшық пайдаланылады. Оның бірі – генерациялық камера деп аталады, онда жұмысшы (генераторлық), индикаторлық, салыстыру электродтары және тұз көпіршесінің бір ұшы батырылады. Ол екі камера арасындағы байланысты қамтамасыз етеді.
Екінші электродтық камера – бұл инертті электролит ерітіндісі құйылған ыдыс. Онда көмекші электроды және тұз көпіршесінің екінші ұшы батырылады.
Индикациялық тізбек рН-метр қондырғысынан тұрады: оның екі электроды - индикаторлық шыны электроды мен салыстырмалы жартылай элемент - қаныққан к.э. (немесе хлоркүміс электроды) титрленетін ерітінді құйылған ұяшыққа батырылады.
 |
22.1-сурет. Кулонометриялық титрлеуге арналған қондырғының принципиальды схемасы:
1 – кулонометриялық титрлеуге арналған ұяшық; 2 – жұмысшы генераторлық электрод; 3 – көмекші электрод; 4 – индикаторлық электродтар; 5 – биполярлы мембрана; 6 – көмекші электродқа арналған камера; 7 – генераторлық электродтан өткен ток күшін өлшеуге арналған амперметр; 8 – индикаторлық электродтағы ток күшін өлшеуге арналған амперметр; 9 – вольтметр; 10 – реостат; 11 – ток көзі; 12 – кілт; 13 – магниттік араластырғыш роторы.
Кулонометриялық титрлеу принципін құрамында НВr бар ерітіндідегі Ғе (ІІІ) ионын анықтау мысалымен қарастырайық. Ерітіндідегі Ғе (ІІІ) ионы Ғе (ІІ) ионына дейін тотықсыздана алады. Бұл процесс платина катоды мен күміс анодынан тұратын ұяшықта тікелей тотықсыздандыру арқылы жүзеге асады. Сәйкес вольтамперограммада (22.2-сурет, 1-ші қисық) екі толқын байқалады, оның бірі ҒеВr2+ ионының, ал екіншісі – Н+ ионының тотықсыздануына сәйкес келеді. Егер ұяшықтан тұрақты ток өтетін болса (оның мәні а деп белгіленген), катодтың бастапқы потенциалы шамамен +0,40В (ҚКЭ бойынша), яғни 22.2-суреттегі 1-ші қисық пен а мәнінің қиылысқан нүктедегі потенциалға тең болады. Электролиз кезінде темір (ІІІ) тотықсызданады, сондықтан ҒеBr2+ диффузиялық тогы біртіндеп азаяды. Бұл, катод потенциалы кенеттен –0,3В -қа тең болғанша азая береді, бірақ Н+ ионының тотықсыздану потенциалына жетпейді (2-ші қисық). Осы сәттен бастап Ғе (ІІІ) ионының тотықсыздануы мен Н2 бөлінуі бірмезгілде жүреді, осының нәтижесінде ток бойынша шығым 100%-тен төмен болады, бұл анализ үшін тиімсіз.
Енді осы экспериментті, ерітіндіге артық мөлшерде титан (ІV) ионын қосып жүргізген жағдайды қарастырайық. НВr қатысында титан (ІV) ионы едәуір терісірек потенциалда, титан (ІІІ) ионына дейін тотықсызданады (2-ші қисық). Ток күші қайтадан а -ға теңескенде, онда темір (ІІІ) иондары қайта тотықсызданады, бұл тотықсыздану диффузиялық токтың мәні а мәніне дейін төмендегенше жүреді. Дегенмен, осы кездегі катод потенциалы –0,3В емес, тек бар болғаны –0,05В қана болады. Осы мезеттен бастап Ғе (ІІІ) және Ті (ІV) иондарының бірмезгілде қатар тотықсыздануы басталады, бірақ бұл кездегі токтың тиімділігі Ті (ІІІ) ионының Ғе (ІІІ) ионымен сандық әрекеттесуіне қарамастан төмендемейді және жалпы нәтиже темірдің бір атомын тікелей немесе жанама жолмен тотықсыздандыруға жұмсалған бір электрон бойынша анықталады. Нәтижесінде қойылған талапқа сәйкес ток бойынша шығым 100%-ті құрайды.
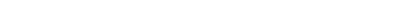 |
22.2-сурет. Платина катоды мен қаныққан к.э. пайдаланып HBr ерітіндісінде ток-потенциал тәуелділігі бойынша түсірілген қисықтар:
1 – Ғе (ІІІ) иондарына тән; 2 – Ғе (ІІІ) иондарының аз концентрациясындағы;
3 – Ті (ІV) иондарына тән
Осыған ұқсас жағдай, егер ток күші а -ға емес, б мәніне тең болса, онда титан (ІV) және темір (ІІІ) иондарының бір мезгілдегі тотықсыздануы алғашқы сәттен бастап-ақ жүреді.
Жоғарыда суреттелген эксперимент кезінде, анодта ерігіштігі аз күміс бромиді түзіледі, сондықтан оның кері әсері болмайды:
Ag + Br- ® AgBr + e
Дегенмен, көптеген титрлеу жағдайларында анодта ерімтал қосылыстар түзілуі мүмкін, егер арнаулы шаралар қолданбаса, ток бойынша шығым төмендеп кетеді.
Пайдаланған әдебиеттер:
42. Алексеев В.Н. Количественный анализ М.: Химия, 1974
43. Воскресенский А.Г., Семиколенов Г.Ф., Солодкин И.С. Сборник задач и упражнении по аналитической химии. М.: Высшая школа, 1985.
44. Дорохова Е.Н., Прохова Г. В. Аналитическая химия. Физико –химические методы анализа. М.: Высшая школа, 1991
45. Захарова Э.А. Обработка результатов химического анализа. Томск.: Изв-во Томск. Уни-та, 1984
46. Крешков А.П. Основы аналитической химии. М.: Химия, 1971, т. 1,2.
47. Логинов Н. Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. М.: Химия, 1979.
48. Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1989.
49. Пономарев В.Д. Аналитическая химия 2ч. М.: Высшая школа, 1982
50. Фритц Дж., Шенк Г. Количественный анализ М.: Высшая школа, 1978
51. Чарыков А.К. Математическая обработка результатов химического анализа. Методы обноружения и оценок ошибок. Л.: Химия, 1984
52. Ярославцев А.А. Сборник задач и упражнений по аналитической химии. М.: Высшая школа, 1979
№ 11 Лекцияның тақырыбы: Тұндыру әдісіне негізделген кулонометриялық титрлеу
Сабақтың жоспары:
- Тұндыру әдісі
- Комплекс түзілу әдісі
Сабақтың мақсаты:
Бұл әдіс бойынша галогенид-иондарын анықтауға болады. Ол үшін жұмысшы электроды ретінде күміс анодын қолданады. Галогенид-иондарының қатысында жұмысшы электродының тотығуы галогенидтердің жоқ кездегісімен салыстырғанда, кішірек оң потенциалда жүзеге асады. Осы кездегі шектелген ток ерітіндідегі Наl- иондарының концентрациясына пропорционалды. Электролизерде екі электрохимиялық реакция жүреді:
Ag + Hal- - e ® AgHal ¯
Ag – e ® Ag+
-------------------------
Ag+ + Hal- «AgНаl ¯
Соңғы теңдеуден, түзілген Ag+ иондарының ерітіндіде диффузияланып, ондағы Hal- иондарымен химиялық әрекеттесетіні көрінеді. Осылайша Hal- иондарының концентрациясы азаяды, осыған сәйкес алғашқы теңдеу үшін электролиз тогының үлесі де кемиді. Ал екінші теңдеуге сәйкес электролиз тогының үлесі артады. Hal- иондары толығымен тұнбаға түсіп болғаннан кейін, ерітіндіде артық мөлшерде Ag+ иондары генерацияланады. Соңғы электрохимиялық реакцияға жұмсалған электр мөлшері генерацияланған Ag+ иондарына эквивалентті. Ұяшықтан өткен электр тогының жалпы мөлшері, ерітіндідегі Hal- иондарының мөлшерімен сәйкес келеді және оның мөлшері AgHal тұнбасының электрохимиялық немесе химиялық жолмен түзілгендігіне тәуелсіз. Бұл ерітіндідегі Hal- иондарының мөлшерін 1-ші теңдеу бойынша анықтауға мүмкіндік береді.
Бұл әдіс металдық сынап электроды мен комплексон ІІІ ерітіндісі арасындағы реакция негізінде көптеген катиондарды анықтауда жиі пайдаланылады. Бұл кезде анықталынатын катион титрантпен тұрақтылығы жоғары комплекстік қосылыс түзеді.
Металдық сынап Н2Y2- иондары қатысында аздаған оң потенциалда тотыға алады:
Hg + Н2Y2- - 2e ® НgY2- + 2H+
Hg - 2e ® Hg2+
Электродта жүретін осы екі реакциялардан басқа ерітіндіде түзілген Hg2+ иондары Н2Y2- иондарымен химиялық әрекеттеседі:
Hg2+ + Н2Y2- «Н2Y2- + 2H+
Химиялық реакция аяқталғаннан кейін ерітіндіде Hg2+ иондары бос күйінде пайда болады, ал оларды сәйкес әдістер арқылы көз жеткізіп, соңғы нүктені анықтауға болады. Титрлеу кезінде жұмсалған электр мөлшері мен Н2Y2- иондарының мөлшерін есептей отырып, анықталынатын заттың сандық мөлшерін табады.
Кулонометрияда этилендиаминтетраацетатты комплексін темірді катодты тотықсыздандыру арқылы алады. Бұл реагенттің көмегімен аз мөлшердегі кальцийді, қорғасынды және мырышты анықтауға болады.
Комплексонометриялық кулонометрияда белгілі бір нақты қосылыстармен ерігіштігі аз немесе комплекс түзе генерацияланатын реагенттер тобы қолданылады, оларға: Ag (І), Hg (І және ІІ), Cu (ІІ), [Fe(CN)6]4-, CN- жатады.
Кулонометриялық титрлеу әдісі сезімталдығы мен дәлдігі жоғары аналитикалық әдіске жатады. Бұл әдіс заттың 10-6 г-экв/л мөлшерін үлкен дәлдікпен анықтауға мүмкіндік береді.
Кулонометриялық титрлеу әдісінің бірқатар жетістіктері мен кемшіліктері бар. Оның жетістіктеріне:
1. Титрлеуді жүргізу үшін стандартты ерітіндіні алдын ала дайындауды қажет етпейді;
2. Тұрақсыз реагенттерді пайдалануға мүмкіндік береді, мұнда тұрақсыз қосылыстар (мысалы, Ті (ІІІ), Сu (І), U (ІV, V), Cr (ІІ) тұздары және т.б.) электродта түзілісімен, ыдырап үлгерместен бірден реакцияға түседі;
3. Кулонометриялық титрлеуді жүргізу процесінде ерітінді сұйытылмайды. Бұл күшті сұйытылған ерітінділердің анализі кезінде ыңғайлы;
4. Кулонометриялық анализ әдісі оңай автоматтандырылады, бұл өндірісте көлемді анықтаулар жүргізуге мүмкіндік береді.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 874; Нарушение авторских прав?; Мы поможем в написании вашей работы!