
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Равновесие в гетерогенных системах
|
|
|
|
Равновесие в гетерогенных системах
Гетерогенные системы содержат, по меньшей мере, две фазы.
Равновесие, которое устанавливается между фазами при физических процессах перехода веществ из одной фазы в другую, называется фазовым равновесием.
Для описания фазового равновесия систем, содержащих жидкие и газообразные фазы, например система
2Н2 (г) + О2 (г)⇄ 2Н2О (ж),
применим закон действующих масс и принцип Ле Шателье. Однако для описания системы, изменяющей свои параметры необходим количественный закон, управляющий равновесием между фазами.
К общим законам гетерогенного равновесия относится правило фаз Гиббса: число степеней свободы системы равно числу независимых компонентов минус число фаз плюс число параметров системы.
Числом независимых компонентов (К) называется число веществ в системе, достаточное для образования всех фаз данной системы. Например, в системе
CaCO3 (тв)⇄ СаО (тв) + CO2 (г)
число компонентов 3, а число независимых компонентов 2.
Число степеней свободы системы (С) – это число независимых термодинамических параметров (n) (температура, давление, электрическое поле и др.), которые можно произвольно менять в некоторых пределах без изменения числа фаз в системе.
| С = К ─ Ф + n. | (6.2.4) |
На фазовое равновесие обычно влияют температура и давление, в этом случае n = 2 и правило фаз можно записать:
| С = К ─ Ф + 2. | (6.2.5) |
Диаграммы, по которым можно определить условия устойчивости фаз и фазового равновесия, называются диаграммами состояния. Для однокомпонентных систем правило фаз имеет вид:
С = 3 ─ Ф.
Однофазная система имеет две степени свободы (С = 2) и называется бивариантной. Двухфазная система имеет одну степень свободы (С = 1) и называется моновариантной, трёхфазная система не имеет степеней свободы (С = 0) и называется инвариантной.
|
|
|
Пример 1. Определить массу аммиака, объемом 1м3, который подвергнется разложению за 40 секунд, если реакция:
2NH3(г) ⇄ N2 (г) +3H2 (г)
идет со скоростью 0,02 моль/л.
Решение
Запишем математическое выражение скорости гомогенной реакции:
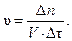
Отсюда количество молей должно быть равно:
∆ n = υ · V · ∆τ = 0,02 · 1 · 40 = 0,8 моль.
По уравнению
0,8 · 2 = 1,6 моль,
тогда масса аммиака, подвергшегося разложению:
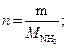
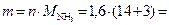 27,2 г
27,2 г
Пример 2. Записать кинетическое уравнение и вычислить, как изменяется скорость прямой реакции, если:
а) уменьшить давление в системе в 3 раза.
б) увеличить в 3 раза концентрацию вещества А.
2А (г) + В (г) ⇄ 3С (г)
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 2179; Нарушение авторских прав?; Мы поможем в написании вашей работы!