
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 2
|
|
|
|
Примеры решения задач
Пример 1
Определите термодинамическую возможность газовой коррозии изделия из углеродистой стали, протекающей по реакции
Fe(т)+ Н2O(г) = FeО(т) + Н2(г),
если это изделие эксплуатируется при 700 ºС под действием водяного пара с относительным давлением p H2O=6 и p H2=1.
Решение. Реакция протекает при условии ∆ G <0. Поскольку p H2=1, ∆ G для этой реакциизависит от давления окислителя –воды следующим образом:
∆ G= ∆ G 0 – RT ln p H2O.
Стандартное значение энергии Гиббса при определенном значении температуры можно рассчитать по уравнению
Δ G = Δ Н – Т Δ S.
Пусть Δ Н иΔ S не зависят от температуры, тогда они могут быть определены по закону Гесса для данной реакции:
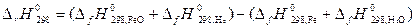 =
=
= (– 263,68 +0) – (0–241,84)= – 21,84 кДж,
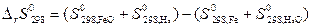 =
=
= (58,79+130,6) – (27,15+188,84)= –26,61 Дж/К,
Δ G 0 = –21840 – 973(–26,61)= 4051,5 Дж,
∆ G= 4051,5 – 8,314 · 973 ln6= –10404,36 Дж.
Таким образом, коррозия углеродистой стали при 700 ºС возможна.
Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. Стандартный потенциал цинка равен (–0,763 В), кадмия (–0,403 В). Поэтому цинк будет являться анодом, а кадмий – катодом.
Анодный процесс: Zn0 – 2 e –= Zn2+;
катодный процесс:
в кислой среде 2H+ + 2 e –= H2,
в нейтральной среде O2 + 2H2O + 4 e –= 4OH–.
Поскольку ионы двухвалентного цинка при взаимодействии с гидроксогруппой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(OH)2.
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 833; Нарушение авторских прав?; Мы поможем в написании вашей работы!