
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Качественный анализ
|
|
|
|
И анализ вещества
Химическая идентификация
В практической деятельности специалистов часто возникает необходимость идентификации (обнаружения) того или иного вещества, а также количественной оценки (измерения) его содержания, что является предметом изучения аналитической химии.
Аналитическая химия – это наука о методах определения химического состава вещества и его структуры.
В современной аналитической химии можно выделить качественный анализ, который решает вопрос о том, какие компоненты входят в состав анализируемого объекта, и количественный анализ, который даёт информацию о количественном содержании компонентов. При проведении качественного и количественного анализа измеряют аналитический сигнал – свойство анализируемого вещества, которое позволяет судить о наличии в нём тех или иных компонентов. Это может быть сила тока, ЭДС системы, интенсивность излучения, цвет и т. д.
Классификацию видов анализа можно проводить по различным признакам. Например, в зависимости от количества анализируемого вещества, объема растворов, используемых для анализа, а также от применения техники выполнения эксперимента методы анализа делят на макро-, полумикро-, микро- и ультрамикроанализы.
Полумикроанализ имеет ряд преимуществ: экономятся время и реагенты, повышается надежность результатов анализа благодаря использованию более специфических и высокочувствительных реагентов, уменьшается расход реактивов и материалов.
Задачей качественного анализа является определение химических элементов, ионов, атомов, молекул и т. д. в анализируемом веществе (объекте).
Качественный анализ можно проводить как химическими, так и инструментальными (физическими и физико-химическими) методами.
|
|
|
Анализ исследуемого вещества в качественном химическом анализе можно проводить «мокрым» и «сухим» путем. В первом случае анализ осуществляют в растворах путем добавления соответствующих реактивов. Во втором случае определение состава вещества основано на его способности окрашивать в характерный цвет бесцветное пламя горелки или давать окрашенные «перлы» при сплавлении с бурой. Открытие отдельных ионов в полумикроанализе производится в основном «мокрым путем».
Для открытия ионов в растворах применяют различные характерные реакции, которые сопровождаются внешними эффектами – возникновением аналитического сигнала, например, изменением цвета раствора, выпадением или растворением осадка, выделением газа.
Вещества, с помощью которых открывают ионы, называются реагентами на соответствующие ионы, а происходящие при этом химические превращения – аналитическими реакциями.
Применяемые в качественном анализе реакции должны протекать быстро, отличаться высокой чувствительностью и по возможности являться необратимыми.
Чувствительность реакций определяет возможность обнаружения вещества в растворе. Она характеризуется пределом обнаружения ( о ткрываемым минимумом), предельной концентрацией, предельным разбавлением и минимальным объёмом предельно разбавленного раствора.
Предел обнаружения – это минимальное количество компонента, которое может быть открыто с помощью данной аналитической реакции. Предел обнаружения выражают в микрограммах (мкг), обозначают g (1g = 0.001 мг = 10–6 г).
Предельная концентрация – это наименьшая концентрация (C min), при которой определяемое вещество может быть обнаружено в растворе данной аналитической реакцией с вполне определенной вероятностью (P), обычно равной единице. Предельную концентрацию обозначают C min, P и выражают в г/мл.
|
|
|
Предельное разбавление (V lim) – максимальный объём раствора, в котором может быть обнаружен 1 г данного вещества при помощи данной аналитической реакции. Предельное разбавление выражается в мл/г.
Предельная концентрация и предельное разбавление связаны соотношением
C min =  . .
| (14.1.1) |
Минимальный объём предельно разбавленного раствора (V min) – наименьший объём раствора, необходимый для обнаружения открываемого вещества данной аналитической реакцией. Выражается в мл.
Таким образом, получается, что
C min= 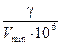 Þ g = C min ∙V min ∙ 10 6 = Þ g = C min ∙V min ∙ 10 6 = 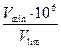 . .
| (14.1.2) |
В качественном анализе применяются только такие реакции, предел обнаружения (открываемый минимум) которых не превышает 50 мкг.
По числу компонентов, взаимодействующих в данных условиях с применяемым реагентом и дающих аналитический сигнал, реакции и реагенты делятся на групповые, избирательные и специфические.
Групповыми называются реакции, когда с реагентом в данных условиях взаимодействует и дает аналитический сигнал целая группа ионов, реагент называется групповым. Например, S2–при pH = 5 осаждает Ag+, Pb2+, Bi3+, Cd2+, Sn2+, 4+и др. Следовательно, S2–– групповой реагент, а осаждение сульфидов – групповая реакция. Групповые реакции в основном используют для разделения целых групп ионов.
В лабораторном практикуме для проведения систематического анализа катионов наиболее часто используется метод, основанный на разделении катионов по кислотно-основному принципу (табл. 14.1.1).
Таблица 11.1.1
Кислотно-основная классификация катионов
| № группы | Название | Катионы | Групповой реагент |
| I | Растворимая | Na+, K+, NH4+ | нет |
| II | Хлоридная | Ag+, Pb2+, Hg22+ | 2н HCl осаждает соответствующие хлориды |
| III | Сульфатная | Ca2+, Ba2+, Sr2+ | 2н H2SO4 осаждает соответствующие сульфаты |
| IV | Амфотерная | Al3+, Cr3+, Zn2+, Sn2+, Sn4+, As3+, As 5+ | NaOH образует растворимые в избытке реагента гидроксиды |
| V | Гидроксидная | Fe2+, Fe3+, Mn2+, Mg2+, Bi3+, Sb3+, Sb5+ | 2н NaOH осаждает соответствующие гидроксиды |
| VI | Аммиакатная | Cu2+, Ni2+, Co2+, Cd2+, Hg2+ | 2н NH4OH образует гидроксиды, растворимые в избытке реагента с образованием аммиакатов |
Избирательными (селективными) называются реакции, когда с реагентом в данных условиях взаимодействует и дает аналитический сигнал ограниченное число компонентов. Такой реагент называется избирательным. Например, магнезиальная смесь (аммиачный раствор MgCl2 и NH4Cl) образует белый мелкокристаллический осадок с двумя ионами PO43– и AsO43–. Избирательные реакции используют как для разделения, так и для обнаружения ионов.
|
|
|
Специфическими называются реакции, когда с реагентом в данных условиях взаимодействует и дает аналитический сигнал один компонент. Реагент называется специфическим. Такие реакции очень удобны для обнаружения ионов, но число их ограниченно. Некоторые специфические реагенты для идентификации катионов представлены в табл. 11.1.2.
Таблица11.1.2
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 2447; Нарушение авторских прав?; Мы поможем в написании вашей работы!