
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ВВЕДЕНИЕ 2 страница
|
|
|
|
3. Как изменяется восстановительная активность металлов II-А подгруппы? Как изменяется основной характер оксидов и гидроксидов этих металлов?
4. Напишите электронные формулы атомов Ni, P и соответствующих ионов: Ni3+, P3‾.
Вариант №11
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) железа; б) селена.
2. Какую низшую степень окисления проявляют: хлор, сера, азот, углерод? Составьте формулы водородных соединений этих элементов. Как изменяется восстановительная способность этих соединений?
3. Укажите самый активный металл и неметалл пятого периода. Напишите формулы их оксидов и укажите их характер.
4. Напишите электронные формулы атомов Br, Mn и соответствующих ионов: Br‾, Mn6+.
Вариант №12
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) вольфрама; б) фосфора.
2. Как изменяются свойства р–элементов V-А подгруппы? Составьте формулы соединений, отвечающих их низшей и высшей степеням окисления.
3. Хлор образует соединения, в которых он проявляет степени окисления 1+, 3+, 5+, 7+. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Как изменяется сила кислот?
4. Напишите электронные формулы атомов Al, As и соответствующих ионов: Al3+, As3‾.
Вариант №13
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) марганца; б) германия.
2. Как изменяется кислотно-основной характер оксидов и гидроксидов хрома, соответствующих степеням окисления 2+, 3+, 6+?
3. Как изменяется окислительная активность, неметаллические свойства элементов VІІ-А подгруппы? Составьте формулы водородных соединений элементов этой подгруппы.
|
|
|
4. Напишите электронные формулы атомов Ca, Sn и соответствующих ионов: Ca2+, Sn4+.
Вариант №14
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) бария; б) брома.
2. На каком основании хром и сера, фосфор и ванадий располагаются в одной группе? Почему их помещают в разные подгруппы? Составьте формулы высших оксидов этих элементов и определите их характер.
3. Какое состояние атома называется возбужденным? Изобразите распределение электронов по квантовым ячейкам в нормальном и возбужденном состояниях атома серы.
4. Напишите электронные формулы ионов: Ge4‾, Pb2+.
Вариант №15
1. Исходя из положения элементов в периодической системе, дайте характеристику атомов: а) олова; б) фосфора.
2. Что характеризует спиновое квантовое число электрона? Какова максимальная спин-валентность атома с распределением валентных электронов …5s25p3?
3. Как изменяется электроотрицательность, окислительная активность, неметаллические свойства р-элементов пятого периода? Составьте формулы высших оксидов этих элементов.
4. Напишите электронные формулы ионов: Cr3+, Cl‾.
4. ТЕМА: "Химическая связь, строение молекул"
Теория химической связи относится к числу основных вопросов курса химии, т. к. свойства веществ и их реакционная способность зависят не только от состава, строения молекул, но и от типа химической связи между атомами. При изучении этой темы необходимо:
- разобраться в механизме образования ионной, ковалентной и металлической связей;
- усвоить свойства и разновидности ковалентной связи;
- изучить особенности свойств соединений с различными типами химических связей;
- приобрести навыки в составлении электронных схем образования молекул с различными типами химической связи.
1. Укажите тип химической связи в молекулах соединений вашего варианта.
2. Составьте электронные схемы образования молекул с ковалентной связью. Электроны, каких орбиталей атомов принимают участие в образовании ковалентной связи? Определите валентность и степени окисления атомов в молекуле.
|
|
|
3. Изобразите электронными уравнениями процессы образования соединений с ионной связью.
Варианты контрольных заданий в таблице №2
| №варианта | Формулы соединений | ||||
| I2 | HI | CrCl3 | PbO | (H2O)n | |
| NH4Cl | BaI2 | AsH3 | K2O | F2 | |
| Cl2 | Mn2O3 | CH4 | ZnS | SiO2 | |
| Fe2O3 | N2 | NaBr | NH4+ | SO2 | |
| Al | MgO | N2 | H2S | FeCl3 | |
| PCl3 | HF | Mn2O3 | Cl2 | PI2 | |
| CO2 | H2S | PbCl4 | Fe2S3 | Br2 | |
| KOH | Br2 | ZnO | AlBr3 | H2O | |
| CuCl | HBr | CO2 | Cr2O3 | I2 | |
| O2 | CaS | Na2O | H2S | CCl4 | |
| (HF)n | SiBr4 | Cl2 | CuO | AlI3 | |
| Cu | F2 | Al2O3 | KBr | SiO2 | |
| Br2 | CH4 | NaOH | Cu2O | Al2S3 | |
| NH3 | SiO2 | MgBr2 | CrO | I2 | |
| HBr | Fe2O3 | (H2O)n | Cl2 | FeCl3 |
5. ТЕМА: " Комплексные соединения"
При изучении этой темы необходимо:
- разобраться в механизме донорно-акцепторной связи и особенностях координационных соединений, их структуре, устойчивости и типах лиганд;
- уметь определять координационное число иона-комплексообразователя, его заряд, а также заряд комплексного иона; дать названия рассматриваемым комплексным соединениям.
- приобрести навыки в составлении уравнений реакций образования и диссоциации комплексных соединений;
- иметь представление о значении и применении минеральных, органических и органоминеральных комплексных соединений в сельском хозяйстве.
1. Заполните пропуски в таблице №3 и напишите выражения для констант диссоциации (нестойкости) комплексных ионов.
| № | Комлексообразователь | Лиганды | Координационное число | Внутренняя сфера комплекса | Ионы внешней сферы | Формула комплексного соединения |
| К2[Zn(OH)4] | ||||||
| Pt4+ | Cl─ | K+ | ||||
| [Cu(NH3)4]2+ | SO42─ | |||||
| Al3+ | OH─ | Na+ | ||||
| Cr3+ | H2O | Cl─ | ||||
| K[BF4] | ||||||
| [Zn(OH)4]2─ | Na+ | |||||
| Fe3+ | CN─ | K+ | ||||
| Au3+ | Cl─ | H+ | ||||
| K[Ag(CN)2] | ||||||
| [Co(NH3)6]3+ | Cl─ | |||||
| Ni2+ | H2O | SO42─ | ||||
| K2[Ni(CN)4] | ||||||
| Ag+ | NH3 | Cl─ | ||||
| [Al(OH)4]─ | K+ | |||||
| Na3[Co(NO2)6] | ||||||
| Pt2+ | NH3 | Cl─ | ||||
| [Ni(NH3)6]SO4 | ||||||
| [FeF6]4─ | K+ | |||||
| Na3[CoF6] | ||||||
| Al3+ | H2O | Cl─ | ||||
| K3[AlF6] | ||||||
| Sn2+ | OH─ | Na+ | ||||
| [Cu(H2O)4]2+ | NO3─ | |||||
| Na3[CoF6] | ||||||
| W4+ | CN─ | K+ | ||||
| Cu2+ | CN─ | Na+ | ||||
| [Ni(NH3)6]2+ | Br─ | |||||
| Na2[HgI4] | ||||||
| Ca2+ | NH3 | Cl─ |
|
|
|
2.Определите заряд внутренней координационной сферы и составьте формулы двух веществ, в которые она входит. Определите координационное число комплексообразователя:
1. [Co3+(NH3)6]; 9. [Co3+(NH3)2(NO2)4];
2. [Ni3+(H2O)4Cl2]; 10. [Pt4+Cl6];
3. [Zn2+ (OH) 4]; 11. [Fe2+ (CN) 6];
4. [Sb5+ (OH) 6]; 12. [Co3+F6];
5. [Co3+ (NH3)5Br]; 13. [Pt4+Br4];
6. [Fe3+F6]; 14. [Au3+Cl4];
7. [Co3+ (NH3)5SO4]; 15. [Co3+(NO2)6];
8. [Pt4+(NH3)4Cl];
3. Составьте молекулярные и ионные уравнения реакций, приводящие к образованию одного малорастворимого вещества:
1. FeCl3+K4 [Fe (CN) 6] →
2. [Pt (NH3)6] Cl4+AgNO3 →
3. K2SO4+Na3 [Co (NO2)6] →
4. [Pt (NH3)3Cl3] Cl+Pb (NO3)2 →
5. FeSO4+K3 [Fe (CN) 6] →
6. NaCl+K [Sb (OH) 6] →
7. [Co (NH3)5SO4] Cl+AgNO3 →
8. [Cu (NH3)4] SO4+BaCl2 →
9. [Co (NH3)5SO4] Br+AgNO3 →
10. [Co (NH3)5Br] SO4+BaCl2 →
11. CuSO4+K4 [Fe (CN) 6] →
12. Na3 [Co (CN) 6] +FeSO4 →
13. K3 [Fe (CN) 6] +AgNO3 →
14. K [Sb (OH) 6] +Na2SO4 →
15. Na3 [Co (CN) 6] +KCl →
4. Представьте указанные в вашем варианте вещества в виде комплексных соединений:
1. KCN∙AgCN; 9. 2KCN∙Ni(CN)2;
2. Co (NO3)3∙6NH3; 10. 2KCl∙PtCl4;
3. 2KCN∙Cu (CN) 2; 11. AgCl∙2NH3;
4. CoCl3∙6NH3; 12. 4KCN∙W (CN) 4;
5. 2KSCN∙Co (SCN) 2; 13. 2NH3∙PtCl4;
6. 4KCN∙Fe (CN) 2; 14. CoF3∙3NaF;
7. KCl∙AuCl3; 15. CrCl3∙6H2O;
8. CuCl2∙4NH3;
6. ТЕМА " Энергетика химических процессов "
Вопросы энергетики химических процессов являются предметом изучения отдельного раздела химии, называемого химической термодинамикой. Основными задачами этого раздела являются определение тепловых эффектов химических реакций, возможности самопроизвольного их течения в заданных условиях, а также выявление наиболее рациональных условий, обеспечивающих эффективный ход процесса.
При изучении данной темы студент должен:
- ознакомиться с основными термодинамическими понятиями и величинами;
- понять сущность и практическую значимость первого закона термодинамики, закона Гесса, второго закона термодинамики;
|
|
|
- разобраться в практических расчетах изобарного теплового эффекта при стандартных условиях ∆Н0298, изменения энтропии ∆S0298 и энергии Гиббса ∆G0298 для любой химической реакции;
- научиться на основе расчетов ∆Н, ∆S, ∆G судить о выделении или поглощении теплоты в процессе реакции, а также возможности ее самопроизвольного протекания.
Задание для самостоятельной расчетной работы
1. Используя справочные данные таблицы №5, определите изобарный тепловой эффект ∆Н0298 химической реакции вашего варианта (таблица №4). Сделайте вывод о выделении или поглощении теплоты в процессе реакции.
2. Определите изменение энтропии ∆S0298 в ходе химической реакции, протекающей при стандартных условиях в идеальном газообразном состоянии. Объясните знак изменения ∆S0298 в результате данной реакции.
3. Определите изменение энергии Гиббса ∆G0298 в ходе химической реакции, используя справочные данные таблицы № 5. По знаку изменения энергии Гиббса ∆G0298 сделайте вывод о возможности самопроизвольного протекания.
Таблица №4
| № Варианта | Химические реакции |
| 1. | 4NH3(г)+5О2(г)↔6Н2О(г)+4NO(г) |
| 2. | CO(г)+3H2(г) ↔CH4(г)+H2O(г) |
| 3. | 4HCl(г)+О2(г) ↔2H2O(г)+Cl2(г) |
| 4. | 2CO(г)+3H2(г) ↔CH4(г)+CO2(г) |
| 5. | 2CH4(г)+О2(г) ↔2СO(г)+4H2(г) |
| 6. | CH4(г)+2H2O(г) ↔CO2(г)+4H2(г) |
| 7. | CH4(г)+H2O(г) ↔CO(г)+3H2(г) |
| 8. | 4NH3(г)+3О2(г) ↔6Н2О(г)+2N2(г) |
| 9. | C2H4(г)+3О2(г) ↔2СO2(г)+2H2O(ж) |
| 10. | 4NH3(г)+5О2(г) ↔6Н2О(ж)+4NO(г) |
| 11. | CH4(г)+О2(г) ↔2СO(г)+2H2O(г) |
| 12. | CO(г)+H2O(ж) ↔CO(г)+H2(г) |
| 13. | CH4(г)+СО2(г) ↔2СO(г)+2H2(г) |
| 14. | CH4(г) ↔C2H2(г)+3H2(г) |
| 15. | 2CO(г)+3H2(г) ↔C2H2(г)+3H2O(ж) |
Таблица №5
| Вещество | Состояние | ∆Н0298, 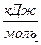
| ∆G0298, 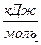
| S0298,  
|
| С2Н2 | г | 226,750 | 209,200 | 200,820 |
| NO | г | 90,370 | 86,690 | 210,200 |
| С2Н4 | г | 52,280 | 68,173 | 219,450 |
| NH3 | г | -45,190 | -16,647 | 192,500 |
| CH4 | г | -74,850 | -50,830 | 186,190 |
| СО | г | -110,520 | -137,270 | 197,910 |
| СО2 | г | -393,510 | -394,380 | 213,650 |
| H2O | г | -241,830 | -228,590 | 188,720 |
| H2O | ж | -285,950 | -237,190 | 69,940 |
| N2 | г | 0,000 | 0,000 | 200,000 |
| H2 | г | 0,000 | 0,000 | 130,590 |
| О2 | г | 0,000 | 0,000 | 205,030 |
| Cl2 | г | 0,000 | 0,000 | 222,950 |
7. ТЕМА " Кинетика химических реакций. Химическое равновесие "
Учение о кинетике химических процессов является одним из важных разделов химии, посвященных изучению скоростей химических реакций в зависимости от различных факторов (концентрации реагентов, температуры, давления, катализаторов и др.). При рассмотрении обратимых химических реакций с одинаковыми скоростями прямого и обратного процессов (состояние химического равновесия), большое значение имеет принцип смещения химического равновесия Ле Шателье.
При изучении данного раздела необходимо:
- выучить закон действующих масс, правило Вант-Гоффа, принцип Ле Шателье;
- уметь составлять выражения скоростей прямой и обратной реакции для любого химического процесса;
- знать, как влияют различные факторы: температура, давление, концентрация, наличие катализатора на скорость химических реакций и особенности действия катализаторов;
- уметь составлять выражение константы химического равновесия, грамотно использовать принцип Ле Шателье при определении смещения химического равновесия.
Пример: N2 + 3H2  2NH3 + Q
2NH3 + Q
Скорость прямой реакции: 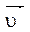 =
= 
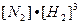 ;
;
Скорость обратной реакции:  =
= 
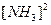 ;
;
Константа равновесия: Кс = 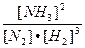
При увеличении концентрации Н2 равновесие сместится вправо, т.к. по правилу Ле Шателье преимущество получит та реакция, в ходе которой водород будет расходоваться, т.е. прямая.
При увеличении температуры равновесие сместится влево т.к. по правилу Ле Шателье преимущество получит та реакция, в ходе которой температура системы понижается, т.е. обратная реакции, идущая с поглощением теплоты.
При увеличении давления равновесие сместится вправо т.к. по правилу Ле Шателье преимущество получит та реакция, в ходе которой давление в системе понижается, т.е. прямая реакции, в ходе которой из 4 моль вещества образуется 2 моль вещества.
Задания для самостоятельной работы
Для каждой нижеприведенной реакции в соответствии с № варианта:
1) напишите кинетические уравнения скоростей прямой реакции, обратной реакции и выражение константы равновесия;
2) определите, в какую сторону сместится химическое равновесие при увеличении концентрации первого исходного вещества, повышении температуры и увеличении давления.
1) 2CO(Г)+O2(Г)↔2CO2(Г) ∆H= -556,0 кДж
2) Fe3O4(К)+CO(Г)↔3FeO(К)+CO2(Г) ∆H= 34,6 кДж
3) N2(Г)+O2(Г)↔2NO(Г) ∆H= 180,0 кДж
4) C(графит)+2N2O(Г)↔CO2(Г)+N2(Г) ∆H= -558,0 кДж
5) 4NH3(Г)+5O2(Г)↔4NO(Г)+6H2O(Ж) ∆H= -1122,6 кДж
6) 2H2(Г)+O2(Г)↔2H2O(Г) ∆H= -483,6 кДж
7) CaCO3 (K) ↔CaO (K) +CO2 (Г) ∆H= 179,0 кДж
8) CH4(Г)+2O2(Г)↔2H2O(Ж)+CO2(Г) ∆H= -890,3 кДж
9) 2SO2(Г)+O2(Г)↔2SO3(Г) ∆H= -198,0 кДж
10) 4NH3(Г)+3O2(Г)↔2N2(Г)+6H2O(Ж) ∆H= -1530,0 кДж
11) C2H5OH(Ж)+3O2(Г)↔2H2O(Ж)+2CO2(Г) ∆H= -1366,9 кДж
12) CO(Г)+H2O(Ж)↔CO2(Г)+H2(Г) ∆H= 2,9 кДж
13) 4HCl(Г)+O2(Г)↔2H2O(Г)+2Cl2(Г) ∆H= -114,4 кДж
14) PCl5(Г)↔PCl3(Г)+2Cl2(Г) ∆H= 92,6 кДж
15) 2HI(Г)↔H2(Г)+I2(Г) ∆H= 52,0 кДж
8. ТЕМА " Окислительно-восстановительные реакции "
Реакции окисления и восстановления играют важную роль при обмене веществ в живых организмах, в процессах горения жидкого и газообразного топлива, в электрохимических процессах гальванических элементов, аккумуляторах, в процессах электролиза, коррозии металлов, почвообразования, разрушения горных пород, в процессах самоочищения водоемов и т. д.
При изучении этой темы необходимо:
- приобрести навыки в определении степени окисления атомов элементов в простых и сложных веществах;
- усвоить понятия "окисление", "восстановление", "восстановитель", "окислитель";
-уметь отличать уравнения окислительно-восстановительных реакций от уравнений обменных реакций;
- получить навыки в составлении уравнений реакций окисления-восстановления, определять тип окислительно-восстановительных реакций.
Задания для самостоятельной работы
1. Укажите, какие из приведенных процессов представляют собой окисление, и какие – восстановление?
№ варианта
1. S→SO42─; MnO4─→Mn2+; Cl─→ClO3─; Cr3+→Cr0;
2. Ca→CaO; S2─→S0; ClO─→Cl2; CrO42─→Cr3+;
3. MnO42─→Mn0; P3─→P5+; NO2─→NO3─; Fe2O3→Fe0;
4. Al0→AlO2─; S2─→SO42─; MnO2→Mn0; Pb4+→Pb2+;
5. Mg2+→Mg0; PH3→H3PO4; AlO2─→Al0; Fe6+→Fe3+;
6. P2O5→PH3; MnO4─→Mn0; Fe2+→H2FeO4; Mn2+→MnO2;
7. NH3→NO; FeO→Fe2O3; SnO2→SnO; CrO42─→CrO;
8. ZnO22─→Zn0; PbO→PbO2; NO2─→NH3; CrO42─→Cr0;
9. BrO3─→Br2; Ni (OH) 3→Ni (OH) 2; MnO2→MnO4─; S0→SO42─;
|
|
|
|
|
Дата добавления: 2014-11-06; Просмотров: 1195; Нарушение авторских прав?; Мы поможем в написании вашей работы!