
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Степень диссоциации
Теория электролитической диссоциации
Электролиты
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Способность электролитов проводить электрический ток называется электролитической проводимостью. Она связана с тем, что направленное перемещение ионов создает поток электрических зарядов.
Механизм диссоциации электролитов в растворе впервые объяснил в
1887 г. шведский ученый С. Аррениус. Он сформулировал основные положения теории электролитической диссоциации.
Электролиты при расплавлении или растворении в воде распадаются (диссоциируют) на ионы — положительно и отрицательно заряженные частицы.
Для количественной характеристики силы электролита используют понятие степени электролитической диссоциации (α).
Степень диссоциации (α) — это отношение числа диссоциированных частиц (n) к общему числу частиц (N) растворенного вещества:
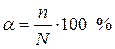
Другими словами, степень диссоциации показывает, какая часть молекул растворенного вещества распалась на ионы. Чем больше степень диссоциации, тем сильнее электролит.
В зависимости от степени диссоциации электролиты можно условно разделить на сильные (α > 30 %) и слабые (α < 30 %).
Сильные электролиты:
· почти все соли;
· некоторые неорганические кислоты: H2SO4, НNO3, HCl, НВr, НI, НС1О4, HMnO4 и другие;
· основания щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Слабые электролиты:
· большинство органических кислот и некоторые минеральные кислоты: Н2СО3, Н2SО3, Н2SiО3, Н2S, HCN, НС1О, HNO2, Н3ВО3, Н3АsО3, H3PO4, HF, НРO3 и другие;
· гидроксиды металлов (за исключением щелочных и щелочноземельных металлов), а также гидроксид аммония NH4OH.
|
|
Дата добавления: 2014-10-15; Просмотров: 629; Нарушение авторских прав?; Мы поможем в написании вашей работы!