
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Титриметричне визначення із сіллю свинцю
Принцип методу. Титриметричне визначення сульфат-іонів ґрунтується на їх взаємодії з іонами РЬ2+ з утворенням малорозчинного осаду PbSO4 (ДР = 1,6∙10-8):
SO42- + Pb2+ → PbS04↓.
Надлишок іонів свинцю після повного осадження PbS04 у процесі титрування встановлюють за допомогою індикатору дитизону, який у точці еквівалентності змінює свій синьо-зелений колір на червоно-фіолетовий внаслідок утворення забарвленого дитизонату свинцю:

Розчинність сульфату свинцю у воді досить значна і дорівнює 1,26∙10-4 М або 12,1 мг SO42-/дм3. Для зменшення розчинності титрування виконують у водно-спиртовому або водно-ацетоновому середовищі. Мінімальна визначувана концентрація дорівнює 10 мг SO42-/дм3 за об'єму проби 100 см3.
Визначенню заважають зависі, колоїди, забарвлені речовини та катіони металів, які утворюють з дитизоном забарвлені комплексні сполуки.
Зависі і колоїди видаляють фільтруванням крізь мембранний фільтр або центрифугуванням проби води, забарвлені гумусові речовини пропусканням проби крізь колонку, наповнену активованим вугіллям (див. Аргентометричне визначення хлоридів); Катіони металів, які заважають аналізу, видаляють збовтуванням 50 - 100 см3 проби води з 5 - 6 г катіоніту КУ-2 в Н+-формі впродовж 5 - 10 хв.
Методика визначення. Пробу води об'ємом 50 - 100 см3 вносять у конічну колбу місткістю 200 - 250 см3, добавляють 5-6 г катіоніту КУ-2 в Н+-формі і збовтують 6-8 разів упродовж 5-10 хв. Після осідання смоли відбирають піпеткою 10-50 см3 розчину в конічну колбу місткістю 100 см3 з позначкою на рівні 10 см3. Якщо об'єм відібраної проби більший за 10 см3, то її випарюють на електроплитці до 10 см3. Якщо вміст сульфат-іонів у воді перевищує 300 мг/дм3, після іонообмінного видалення катіонів, які заважають аналізу, пробу розбавляють дистильованою водою до певного об'єму і враховують це при розрахунках. До 10 см3 проби добавляють 30 см3 етанолу або ацетону і таку кількість дитизону, щоб розчин забарвився у синьо-зелений колір, і титрують розчином РЬ(NО3)2 до зміни забарвлення на червоно-фіолетове, яке не зникає при стоянні. В разі появи синюватого відтінку продовжують добавляти по одній краплі розчин нітрату свинцю за інтенсивного перемішування до повного зникнення синюватого відтінку.
Концентрацію сульфат-іонів Сх (мг/дм3) або Су (ммоль-екв/дм3) обчислюють за рівняннями


де С − концентрація розчину нітрату свинцю, витраченого на титрування, моль-екв/дм3; V 1 − об'єм розчину нітрату свинцю, витрачений на титрування, см3; V − об'єм проби води, взятий для титрування після контакту з катіонітом, см3; 48,03 − молярна маса еквівалента сульфат-іонів 
Реактиви
Розчин нітрату свинцю, 0,02 моль-екв/дм3: 3,31 ± 0,01 г РЬ(NО3)2, х.ч., розчиняють у бідистильованій воді й доводять об'єм розчину до 1 дм3 у мірній колбі. Точну концентрацію розчину визначають титруванням стандартним розчином К2SO4.
Розчин сульфату калію, 0,02 моль-екв/дм3: 0,436 ±0,001 г препарату К2SO4, х.ч., висушеного при 110 °С до сталої маси, розчиняють у бідистильованій воді й доводять об'єм розчину до 250 см3 у мірній колбі.
Дитизон: 0,1 г дитизону С13Н12N4S, х.ч., розтирають у фарфоровій ступці з 5 г бензойної кислоти С7Н6О2.
Етиловий спирт С2Н5ОНабо ацетон С3Н6O.
Розчин соляної кислоти, 4 й 1 моль-екв/дм3: концентровану НС1 (х.ч., d = 1,19 г/см3) розбавляють бідистильованою водою відповідно у співвідношеннях 1: 3 та 1: 12.
Розчин їдкого натру, 1 моль-екв/дм3: 40 г NаОН, х.ч., розчиняють у бідистильованій воді й доводять об'єм розчину до 1 дм3 у мірній колбі.
Катіоніт КУ-2.
Підготовка катіоніту до роботи та його регенерація. Свіжу, не використовувану раніше смолу КУ-2 заливають дистильованою водою і залишають на ніч. Потім воду зливають і на 1 добу заливають смолу розчином соляної кислоти (4 моль-екв/дм3). Якщо розчин забарвлюється, його зливають, промивають смолу 2-3 рази дистильованою водою і знову заливають її таким самим розчином соляної кислоти. Цю процедуру повторюють доти, доки жовтий колір розчину, що знаходиться над смолою, не зникне повністю. Потім проводять 10 − 12 циклів обробки смоли: 80 − 100 г смоли вміщують у лійку зі скляним фільтром (№ 1 або № 2) і послідовно заливають 100 см3 1 моль-екв/дм3 NaОН, 100 см3 дистильованої води, 100 см3 1 моль-екв/дм3 НС1 і знову воду, щоразу відсмоктуючи залишок рідини водоструминною або механічною помпою.
Після останньої обробки катіоніту розчином соляної кислоти його відмивають бідистильованою водою до рН ~7 (контроль індикаторним папірцем) і зберігають під шаром бідистильованої води.
Катіоніт після роботи щоразу збирають в одну колбу й обробляють розчином НС1 (4 моль-екв/дм3) упродовж 8-10 хв. Розчин НС1 зливають, а катіоніт промивають декантацією бідистильованою водою до рН ~7.
Визначення концентрації розчину нітрату свинцю. До 10,0 см3 стандартного розчину К2SO4 добавляють 30 см3 етилового спирту або ацетону, індикатор дитизон і титрують розчином РЬ(NО3)2, як описано в методиці визначення.
Концентрацію РЬ(NО3)2 Сх (моль-екв/дм3) обчислюють за рівнянням
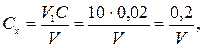
де V1 − об'єм стандартного розчину К2SO4 , см3; С − концентрація стандартного розчину К2SO4, взятого для аналізу моль-екв/дм3; V — об'єм розчину РЬ(NO3)2, витрачений на титрування, см3.
Лабораторна робота №3
|
|
Дата добавления: 2014-11-06; Просмотров: 657; Нарушение авторских прав?; Мы поможем в написании вашей работы!