
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молекулярно-кінетична теорія
|
|
|
|
Молекулярна фізика – розділ фізики, який вивчає будову та властивості речовини, виходячи із молекулярно-кінетичних уявлень про характер руху і взаємодії між частинками, з яких вони складаються. Вчення про те, що всі речовини складаються із окремих частинок – атомів – виникло в Стародавній Греції ще у IV столітті до нашої ери (основоположником атомістичної теорії був філософ Демокрит). Серед інших видатних учених, які займались вивченням молекулярної будови речовини, особливу роль зіграв М.В.Ломоносов, який припустив, що «теплота полягає у внутрішньому русі матерії». Основні уявлення, виказані Ломоносовим, були надалі розвинені Больцманом, Клаузіусом, Максвелом, Авогадро та іншими. Численні дослідження, проведені цими ученими, дозволили сформулювати основніположення молекулярно-кінетичної теорії (МКТ):
1) Всі тіла складаються із найдрібніших частинок – атомів і молекул, які в свою чергу складаються із ще дрібніших елементарних частинок (електронів, протонів, нейтронів). Будова будь-якої речовини дискретна (переривиста).
2) Атоми і молекули речовини завжди знаходяться у безперервному хаотичному русі, який не має переважного напряму. Він називається тепловим, оскільки його інтенсивність визначається температурою.
3) Між частинками будь-якої речовини існують сили взаємодії – притягання та відштовхування, які мають електромагнітну природу.
Ці положення підтверджуються явищами дифузії, броунівського руху, особливостями будови і властивостями газів, рідин, твердих тіл та іншими явищами. Дослідні дані, що лежать в основі МКТ, служать наочним доказом молекулярного руху і його залежності від температури. На відміну від механічного, тепловий рух тіл може привести до зміни їхніх фізичних властивостей. Наприклад, охолоджування води приводить до перетворення її в лід, а нагрівання металу до високих температур викликає його перетворення не тільки в рідину, але і у пару. Протікання теплових процесів безпосередньо пов'язане із структурою речовини, тому теплові явища можуть бути використані для пояснення будови речовини, а в свою чергу, будова речовини дає уявлення про фізичну суть теплових явищ.
|
|
|
Для опису теплових явищ у фізиці застосовуються два основні методи: молекулярно-кінетичний (статистичний) і термодинамічний. Молекулярно-кінетич-ний метод дослідження систем, що складаються із величезної кількості частинок, оперує статистичними закономірностями і середніми значеннями фізичних величин, які характеризують всю сукупність частинок відразу. Процеси, що вивчаються статистичною фізикою, є результатом сукупної дії всіх молекул. Наприклад, температура тіла визначається швидкістю хаотичного руху його молекул, але оскільки у будь-який момент часу швидкості молекул різні, то вона може бути виражена тільки через середнє значення швидкості руху молекул. Говорити про температуру окремої молекули немає сенсу. Термодинамічний метод також досліджує системи, що складаються із великої кількості частинок, але не розглядає їхню мікроструктуру та мікропроцеси, які здійснюються в системі. Ґрунтуючись на основних дослідних законах, названих законами термодинаміки, цей метод оперує фізичними величинами, які характеризують систему в цілому (наприклад, тиск, об'єм, температура), і дозволяє зробити висновки про протікання процесів. Обидва підходи, відрізняючись різними методами дослідження, взаємно доповнюють один одного, утворюючи по суті єдине ціле.
Великі успіхи, досягнуті останнім часом у вивченні будови речовини, розкрили перед нами новий світ – світ найдрібніших частинок. Цей світ одержав назву мікросвіту на відміну від світу крупних тіл – макросвіту. Мікросвіт виявився дуже складним: молекули будь-якого тіла складаються із ще дрібніших – атомів, які, у свою чергу, складаються з електронів і ядер, а ядра включають протони і нейтрони. Атомом називають якнайменшу частинку даного хімічного елементу, яка є носієм його хімічних властивостей. Молекулою називають якнайменшу стійку частинку речовини, що володіє його основними хімічними властивостями і складається з атомів, сполучених між собою хімічними зв'язками. Розміри атомів і молекул дуже малі, і побачити їх неозброєним оком не можна. Дані рентгеноструктурного аналізу показують, що лінійний розмір, наприклад, двоатомної молекули кисню або азоту, складає порядку 4×10-10 м.
|
|
|
Маси окремих атомів і молекул також дуже малі. Наприклад, маса молекули води складає порядку 3×10-26 кг. Але в молекулярній фізиці маси атомів і молекул прийнято характеризувати не абсолютними значеннями (у кілограмах), а безрозмірною величиною, званою відносною атомною А (або молекулярною М) масою. За міжнародною угодою, за одиницю атомної маси прийнята 1/12 маси ізотопу вуглецю 12 С: mc /12=1,66×10-27кг. Відносну молекулярну масу М можна визначити, якщо середню масу молекули розділити на одиничну атомну масу:
 (5.1)
(5.1)
Аналогічно визначається і відносна атомна маса А:
 (5.2)
(5.2)
Оскільки маси окремих молекул відрізняються одна від одної, то однакове число молекул різних речовин мають різну масу. Тому прийнято порівнювати число молекул або атомів у даній речовині із числом атомів, які містяться у 12 грамах ізотопу вуглецю 12С. Відносне число атомів, що містяться у макроскопічному тілі, характеризується фізичною величиною, визначуваною числом специфічних структурних елементів (молекул, атомів або іонів), із яких складається речовина, і званою кількістю речовини n. Кількість речовини – фізична величина, рівна відношенню числа N молекул (або атомів) в даному макроскопічному тілі до числа NA атомів у 12 грамах атомів вуглецю:
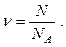 (5.3)
(5.3)
Одиниця виміру кількості речовини – моль. Моль – кількість речовини системи, яка містить стільки ж структурних елементів, скільки атомів міститься у 12 грамах нукліда 12 С вуглецю. Моль будь-якої речовини містить, за визначенням, однакову кількість атомів (молекул), звану числом (сталою) Авогадро:
|
|
|
 (5.4)
(5.4)
У молекулярній фізиці користуються також поняттям молярної маси М, яка визначається як маса 1 моля речовини:
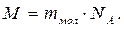 (5.5)
(5.5)
Одиниця виміру молярної маси – кілограм на моль (кг/моль). Виходячи із цього, маса будь-якої кількості речовини дорівнює m=M×n.
У молекулярній фізиці розглядаються макроскопічні системи – системи, що складаються із великої кількості частинок. Для кожної із них неможливо вказати її координату і напрям руху, визначати температуру і тиск. Вимірними є тільки параметри стану всієї сукупності молекул, тобто макроскопічні характеристики. Спочатку з'ясуємо закономірності, яким підкоряються речовини у газоподібному стані. При цьому розглядатимемо ідеалізовану модель реальних газів, – ідеальний газ.
Ідеальним називають такий газ, для якого можна знехтувати розмірами молекул і силами міжмолекулярної взаємодії, а зіткнення молекул між собою та зі стінками посудини вважати абсолютно пружними. Цій моделі цілком задовольняють реальні гази в умовах, близьких до нормальних, а також при низькому тиску і високих температурах. Стан деякої маси газу характеризують залежними одна від одної фізичними величинами, що визначають властивості системи і званими параметрами стану. До них відносяться об'єм V, тиск р і температура Т.
Об'єм газу – частина простору, займана газом. Одиниця об'єму – кубічний метр (м3). Об'єм газу завжди співпадає із об'ємом посудини, в якій знаходиться цей газ.
Тиск – фізична величина, чисельно рівна силі, діючій на одиницю площі поверхні перпендикулярно до неї:
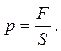 (5.6)
(5.6)
Одиниця виміру тиску – Паскаль (1 Н/м2=1 Па). Кожна молекула газу, ударяючись об стінку посудини, у якій знаходиться, протягом короткого проміжку часу діє на неї із деякою силою. В результаті хаотичних ударів об стінку, середня сила з боку всіх молекул на одиницю площі поверхні стінки і є тиском газу, який вимірюється манометром.
|
|
|
Поняття температури – одне із основних понять не тільки у молекулярній фізиці, але і у фізиці в цілому. Для встановлення її кількісного визначення, потрібно ввести поняття теплової рівноваги. Розглянемо систему із декількох тіл: нагрітий метал (тіло А), воду при кімнатній температурі (тіло Б) та шматок льоду (тіло В). Якщо ці тіла привести у зіткнення, між ними виникне процес теплообміну, при якому зміна енергії кожного тіла системи можна відобразити умовним записом: А®Б®В. Енергія при теплообміні завжди передається від тіла з вищою температурою до тіла з нижчою. Врешті-решт, в системі цих тіл наступить стан, при якому теплообмін між тілами припиниться. Цей стан і називають тепловою рівновагою. Тіла, які знаходяться в тепловій рівновазі, мають однакову температуру. Температура – фізична величина, яка характеризує стан термодинамічної рівноваги макроскопічної системи і визначає напрям теплообміну між тілами.
Отже, якщо система тіл знаходиться в стані теплової рівноваги, то її температура і інші параметри стану (тиск і об'єм) не змінюються із часом. При зміні температури змінюються розміри тіл, їхні об'єми, електричні опори та інші властивості. У більшості всіх фізичних і хімічних явищ виявляється залежність від температури. Тому температуру можна визначати по зміні будь-якої зручної для вимірювання фізичної властивості даної речовини. Для однозначного визначення температури необхідно вибрати термометричнетіло і температурнийпараметр, який мусить змінюватись безперервно і монотонно із температурою (тобто, він не повинен мати однакові значення при різних температурах).
В наш час застосовують тільки дві температурні шкали: Міжнародна практична, градуйована у градусах Цельсія (0С), і термодинамічна, градуйована у Кельвінах (К). Шкала Цельсія визначається двома реперними точками: 00С і 1000С – температурами замерзання та кипіння води за нормальних умов відповідно. Шкала Кельвіна (У.Томсона) визначається однією реперною точкою – температурою замерзання води за нормальних умов, яка за цією шкалою дорівнює 273,15 К. Температура Т =0 К називається нулем Кельвіна (абсолютним нулем). Термодинамічна температура Т і температура t за Міжнародною практичною шкалою зв'язані співвідношенням: T= 273,15 0C+t.
Між термодинамічними параметрами ідеального газу у будь-якому стані існує однозначне співвідношення, яке в загальному вигляді називається рівнянням стану. Для простих систем таке рівняння може бути записане у вигляді: f (p,V,T) = = 0. За допомогою рівняння стану завжди по двох параметрах системи можна визначити третій. Будь-яка зміна у термодинамічній системі, пов'язана зі зміною хоча б одного з трьох її макроскопічних параметрів, називається термодинамічним процесом. Проте, не існує жодного процесу, при якому змінювався б тільки один параметр: зміна одного з них веде до зміни і інших. Процеси, при яких один їх параметрів газу залишається сталим, а два інших змінюються, називаються ізопроцесами. Розглянемо ізопроцеси, яким підлягають ідеальні гази.
1. Процес, що протікає в газі при постійній температурі, називають ізотермічним («ізос» - рівний, «термос» - теплий). У XVII столітті французький фізик Е.Ма-ріотт і англійський фізик Р.Бойль одночасно встановили залежність тиску газу від його об'єму при постійній температурі, названу законом Бойля-Маріотта: тиск даної маси ідеального газу (m=const) при сталій температурі (T=const) змінюється обернено пропорційно до його об'єму:
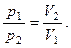 (5.7)
(5.7)

| Закон можна сформулювати інакше: для даної маси газу,
взятого при сталій температурі, добуток тиску газу на його об'єм є величиною сталою:
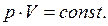 (5.8)
Криві, які зображають залежності між величинами р та V і характеризують властивості речовини при сталій темпера- турі, (рис.5.1) називають ізотермами. Вони є гіперболами, (5.8)
Криві, які зображають залежності між величинами р та V і характеризують властивості речовини при сталій темпера- турі, (рис.5.1) називають ізотермами. Вони є гіперболами,
|
| Рис.5.1. |
розташованими на графіку в координатах р-V тим вище, чим вища температура, при якій відбувається процес.
2. Процес, що протікає в газі при постійному тиску, називають ізобарним («барос» - важкий). Залежність об'єму газу від його температури при постійному тиску встановлена у 1802 році французьким ученим Л.Гей-Люссаком. Проведені ним досліди показали, що збільшення об'єму газу пропорційне приросту температури (закон Гей-Люссака). У шкалі Цельсія закон формулюється так: об'єм даної маси ідеального газу (m=const) при сталому тиску (р=const) здійснюється прямо пропорційно його температурі:
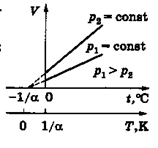 Рис.5.2.
Рис.5.2.
|  (5.9)
де V - об'єм газу при температурі t 0 C, V 0 - його об'єм при 00 С, a - температурний коефіцієнт об'ємного розширення (для всіх газів a= 1/2730 С -1). Графічна залежність об'єму ідеального газу від температури називається ізобарою і має вид прямої лінії (рис.5.2), яка перетинає горизонтальну вісь (температур) в точці –2730С, визначуваної з умови (1+ a×t)=0. Чим більший тиск газу, тим нижче лежить ізоба- (5.9)
де V - об'єм газу при температурі t 0 C, V 0 - його об'єм при 00 С, a - температурний коефіцієнт об'ємного розширення (для всіх газів a= 1/2730 С -1). Графічна залежність об'єму ідеального газу від температури називається ізобарою і має вид прямої лінії (рис.5.2), яка перетинає горизонтальну вісь (температур) в точці –2730С, визначуваної з умови (1+ a×t)=0. Чим більший тиск газу, тим нижче лежить ізоба-
|
бара в координатах V-t. Якщо перенести початок відліку температур в точку абсолютного нуля (–2730С), то відбувається перехід до шкали Кельвіна, і закон Гей-Люссака набуває вигляду:
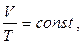 (5.10)
(5.10)
і формулюється так: для ізобарного процесу відношення об'єму ідеального газу до його абсолютної температури є величиною сталою.
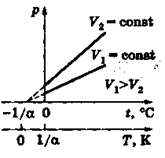
3. Процес, що протікає в газі при постійному об'ємі, називається ізохорним («хорема» - місткість). Дослідження залежності тиску газу від температури при незмінному об'ємі вперше були проведені французьким фізиком Шарлем у 1787 році. Ним було встановлено, що тиск даної маси ідеального газу (m=const) при постійному об'ємі (V=const) здійснюється прямо пропорційно його температурі (за-
| кон Шарля):
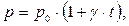 (5.11)
де p - об'єм газу при температурі t 0 C, p 0 - його об'єм при 00 С, g - температурний коефіцієнт тиску (у всіх газів g= = 1/2730 С -1). Графічну залежність тиску ідеального газу від температури називають ізохорою, яка має вигляд прямої лінії (рис.5.3), що перетинає горизонтальну вісь температур в точці –2730 С, яка визначається з умови (1+ g×t)=0. Чим (5.11)
де p - об'єм газу при температурі t 0 C, p 0 - його об'єм при 00 С, g - температурний коефіцієнт тиску (у всіх газів g= = 1/2730 С -1). Графічну залежність тиску ідеального газу від температури називають ізохорою, яка має вигляд прямої лінії (рис.5.3), що перетинає горизонтальну вісь температур в точці –2730 С, яка визначається з умови (1+ g×t)=0. Чим
|
| Рис.5.3. |
більший об'єм газу, тим нижче лежить ізохора в координатах р-t. Якщо перенести початок відліку температур в точку абсолютного нуля (–2730С), то відбувається перехід до шкали Кельвіна, і закон Шарля набуває вигляду:
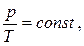 (5.12)
(5.12)
і формулюється так: для ізохорного процесу відношення тиску ідеального газу до його абсолютної температури є величина сталою.
Згадаємо ще два газові закони, встановлені на підставі дослідних даних.
1) Закон Авогадро: моль будь-якого газу при однакових температурі та тиску займає однаковий об'єм. За нормальних умов (р 0 = 1,013×105 Па, Т 0 = 273,15 К) цей об'єм становить Vm= 22,4×10-3 м3/моль.
2) Закон Дальтона: тиск суміші ідеальних газів дорівнює сумі парціальних тисків окремих компонентів, які входять до неї:
 (5.13)
(5.13)
(Парціальним називається тиск, який здійснював би газ, що входить до складу газової суміші, якби він один займав об'єм, рівний об'єму суміші при тій же температурі).
Розглядаючи ізопроцеси, ми вважали, що один із трьох параметрів стану газу залишався сталим. На практиці ж частіше доводиться стикатись з випадками, коли одночасно змінюються всі три параметри стану. Французький фізик Б.Кла-пейрон, об'єднавши закони Бойля-Маріотта, Гей-Люссака та Шарля, вивів рівняння стану ідеального газу:
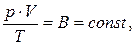 (5.14)
(5.14)
тобто, добуток тиску газу на його об'єм, віднесений до температури газу, є величиною сталою. Цей вираз носить назву рівняння Клапейрона, в якому стала В залежить від маси і молярної маси газу, а також від вибору одиниць тиску, об'єму та температури.
Російський учений Д.І.Менделєєв об'єднав рівняння Клапейрона із законом Авогадро, записавши рівняння для одного моля. Згідно закону Авогадро, при однакових р і Т моль всіх газів займає однаковий молярний об'єм Vm, тому стала буде однаковою для всіх газів. Ця загальна для всіх газів стала позначається R і називається молярною(універсальною)газовою сталою. Рівняння стану ідеального газудля одного моля набуває вигляду:
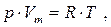 (5.15)
(5.15)
і називається рівнянням Клапейрона-Менделєєва. Числове значення R визначають із цього рівняння, вважаючи, що 1 моль газу знаходиться при нормальних умовах: R=р 0 ×Vm/Т 0 = 8,31 Дж/моль×К. Довільна маса газу m займає об'єм V=Vm×n, де n - кількість молів речовини, а рівняння набуває вигляду:
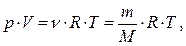 (5.16)
(5.16)
де М – молярна маса газу.
Існує ще одна зручна форма запису рівняння стану ідеального газу. Якщо загальну масу газу надати, як m = m0×N, (m 0 – маса однієї молекули, N – їхня загальна кількість), то молярна маса газу М=m 0 ×NА (NА – число Авогадро). Підставивши в рівняння вирази для m і М, та ввівши позначення R/NA=k= 1,38×10-23 Дж/К, одержимо:
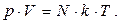 (5.17)
(5.17)
Величина k відноситься до класу універсальних фізичних сталих, яка є газовою сталою, віднесеною до однієї молекули і називається сталою Больцмана. Розділивши обидві частини рівняння на об'єм газу і ввівши позначення N/V=n, зване концентрацією молекул (кількість молекул у одиниці об'єму), одержуємо ще один запис рівняння Клапейрона–Менделєєва:
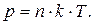 (5.18)
(5.18)
тобто тиск газу пропорційний додатку концентрації молекул газу на його термодинамічну температуру.
Наявність міжмолекулярних сил взаємодії та скінченні розміри молекул є основними відмінностями реальних газів від ідеальних. Ці відмінності безперервно зростають при збільшенні тиску. Сили міжмолекулярної взаємодії мають електромагнітну та квантову природу, виявляються на відстанях близько 10-9¸10-10 м і називаються ван-дер-ваальсовими. Урахування кінцевих розмірів молекул та сил тяжіння між ними дозволяє одержати рівняння стану реальних газів із рівняння Клапейрона-Менделєєва шляхом внесення поправки а/V 2 до тиску і поправки b до об'єму:
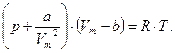 (5.19)
(5.19)
Воно має назву рівняння Ван-дер-Ваальса для одного моля газу. Поправка b до об'єму враховує, що фактичний вільний об'єм, у якому можуть рухатись молекули реального газу, зменшується на об'єм самих молекул та об'єм проміжків між молекулами при їхній щільній упаковці (вона враховує сили відштовхування між молекулами і дорівнює їхньому власному збільшеному учетверо об'єму). Поправка ж до тиску враховує дію сил притягання між молекулами реального газу, що приводить до появи додаткового внутрішнього тиску, який обернено пропорційний до квадрату об'єму газу. Константи а та b залежать від природи газу і визначаються дослідним шляхом. Для довільної маси реального газу рівняння Ван-дер-Вааль-са має вигляд:
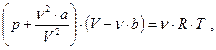 (5.20)
(5.20)
Тиск газу виникає в результаті численних ударів його молекул об стінки посудини. При зіткненнях молекули передають стінкам свій імпульс, а отже, діють на них із силою, тобто, чинять тиск. Зробивши декілька припущень, нескладно одержати рівняння, яке зв'язує макроскопічну величину – тиск газу, із мікроскопічними характеристиками його молекул. Це рівняння має назву основного рівняння молекулярно-кінетичної теорії (МКТ) газів (рівняння Клаузіуса) і виглядає так:
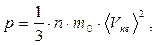 (5.21)
(5.21)
де n – концентрація молекул газу, m 0 – маса молекули, <Vкв> - середня квадратична швидкість молекул, визначувана співвідношенням:
 (5.22)
(5.22)
Помноживши та розділивши основне рівняння МКТ на 2, перепишемо його у іншому вигляді:
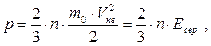 (5.23)
(5.23)
де Есер – середня кінетична енергія поступального руху молекул. Порівнявши цю формулу із виразом (5.18), одержимо співвідношення для середньої кінетичної енергії молекул:
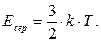 (5.24)
(5.24)
Звідси випливає, що при абсолютному нулі (Т= 0) поступальний рух молекул газу припиняється, а отже, і його тиск дорівнює нулю. Ця формула також розкриває молекулярно-кінетичне тлумачення температури: температура газу є мірою середньої кінетичної енергії поступального руху молекул. Записавши це співвідношення у вигляді:
 (5.25)
(5.25)
одержимо вираз для обчислення середньої квадратичної швидкості:
 (5.26)
(5.26)
Таким чином, знаючи температуру газу, можна визначати середню квадратичну швидкість руху його молекул.
Хоча молекули рухаються хаотично, а при зіткненнях змінюють свої швидкості, середня квадратична швидкість їхнього руху при постійній температурі залишається сталою. Це означає, що в газі, який знаходиться в стані теплової рівноваги, встановлюється деякий стаціонарний (що не змінюється із часом) розподіл молекул за швидкостями, який підлягає цілком певному статистичному закону. Вперше цей закон виведено Максвеллом, який одержав вираз для функції роз-
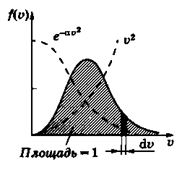
| поділу молекул f (V), яка характеризує вірогідність того, що швидкості молекул лежать у даному одиничному інтервалі швидкостей dV і має вигляд (рис.5.4):
 (5.27)
Множник А визначається із умови нормування для функ-ції f (V): (5.27)
Множник А визначається із умови нормування для функ-ції f (V):
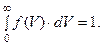 (5.28) (5.28)
|
| Рис.5.4. |
Підставивши сюди вираз для f (V) та проінтегрувавши, одержимо:
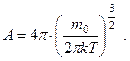 (5.29)
(5.29)
У показнику експоненціальної функції маємо узяте із мінусом відношення кінетичної енергії молекули до її середньої енергії (k×T). Графік функції f (V), починаючись в нулі, досягає максимуму, а потім асимптотично прямує до нуля (рис.5.4); вона несиметрична щодо V. Швидкість, при якій функція розподілу досягає максимуму, називається найвірогіднішою швидкістю. Продиференціювавши функцію f (V) по аргументу V та прирівнявши результат до нуля, одержимо вираз для найвірогіднішої швидкості:
 (5.30)
(5.30)
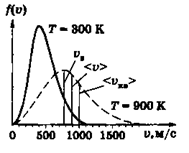
| Цьому значенню відповідає максимальна вірогідність того, що швидкості молекул лежать у одиничному інтервалі поблизу нього. Очевидно, що при підвищенні температури, значення найвірогіднішої швидкості стає більшим (рис.5.5), і максимум функції розподілу зміщується праворуч. Це означає, що рухомих швидше молекул стає більше і відповідає фізичному змісту температури. Перейшовши від змінної V до змінної m0×V 2 / 2, легко одержати |
| Рис.5.5. |
вираз для функції розподілу молекул ідеального газу по енергіях їхнього теплового руху, яка набуває вигляду:
 (5.31)
(5.31)
Закон Максвела про розподіл молекул за їхніми швидкостях та енергіями вперше одержав експериментальне підтвердження у дослідах Штерна (у 1920 році), а ще точніше – у досліді Ламмерта (у 1929 році).
При розгляданні закону розподілу Максвелла передбачалось, що молекули рівномірно розподіляються по всьому об'єму посудини, що справедливо для малих об'ємів. Для великих об'ємів рівномірність розподілу молекул по об'єму порушується через дію сили тяжіння, внаслідок чого густина, а отже, і концентрація молекул будуть неоднаковими. Якщо розглянути молекули повітря у полі тяжіння Землі, то тиск атмосфери залежить від висоти над поверхнею Землі. Припустивши, що прискорення вільного падіння g і температура повітря Т не залежать від висотипідйому, неважко вивести залежність тиску повітря у атмосфері від висоти підйому над поверхнею Землі. Ця залежність носить назву барометричної формули і має вигляд:
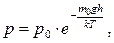 (5.32)
(5.32)
де р0 – тиск на поверхні Землі (звичайно, на рівні моря). Використовуючи співвідношення p=n×k×T, формулу можна переписати:
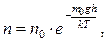 (5.33)
(5.33)
Із формули виходить, що при пониженні температури кількість частинок на відмінній від нуля висоті зменшується, і при Т= 0 перетворюється в нуль. Це означає, що при абсолютному нулі всі молекули атмосфери розташувалися б на земній поверхні. Оскільки потенціальна енергія молекули на висоті h становить m0gh, то формулу можна переписати у вигляді:
 (5.34)
(5.34)
Це співвідношення називається розподілом Больцмана. Воно показує, що при постійній температурі концентрація (густина) газу більша там, де менша потенціальна енергія його молекул. Цей закон є універсальним: якщо частинки мають однакову масу і знаходяться у стані хаотичного теплового руху, то воно справедливе не тільки у полі сил тяжіння, але і у будь-якому зовнішньому потенціальному полі. Цей розподіл висловлює умову рівноваги між тепловим рухом, який намагається максимально розсіяти частинки, та дією зовнішніх потенціальних сил, що намагаються максимального розшарувати частинки по значеннях їхніх потенціальних енергій. Експериментальне підтвердження справедливості цього розподілу було одержане при визначенні сталої Авогадро Ж.Перреном.
Явища переносу у газах
Середня швидкість руху молекул досить велика. Вона становить сотні і навіть тисячі метрів за секунду. Проте, здійснюючи хаотичний рух, молекули газу при нормальних умовах зазнають величезної кількості зіткнень протягом 1 с, тому відстані, які молекули проходять від однієї точки А до іншої В, виявляються набагато більшими за переміщення АВ між цими точками. Якщо певна молекула рухається від точки А до точки В, то її траєкторія завдяки зіткненням з іншими молекулами є ломаною лінією. Точно простежити за траєкторією частинки, яка прийшла із точки А у точку В, неможливо, тому реальне зміщення молекули в газі визначають швидкістю дифузії – відношенням переміщення молекули АВ до проміжку часу, за який воно відбувається. Швидкість дифузії молекули набагато менша за середню швидкість її молекулярного руху. Щоб оцінити швидкість дифузії молекул, введемо поняття середньої довжини вільного пробігу lсер, як середню відстань між двома послідовними зіткненнями.
Припустимо, що молекули уявляють собою кульки діаметром d, а їхня концентрація дорівнює n. Будемо вважати, що траєкторія певної молекули А прямолінійна, а всі молекули, які зустрічаються у неї на шляху, нерухомі. На своєму шляху молекула А декілька разів стикається з іншими молекулами, центри яких лежать не далі за d від траєкторії її руху. Отже, можливо припустити, що зоною, у якій відбувається взаємодія даної молекули А з іншими – це криволінійний “ламаний” циліндр діаметром d. За одну секунду молекула А проходить шлях, який чисельно дорівнює її середній швидкості Vcep, і стикнеться із тими молекулами, які знаходяться усередині цього циліндру, об¢єм якого становить V=pd 2 ×Vcep. Середня кількість зіткнень Zcep молекули А з іншими дорівнює їхній кількості у об¢ємі такого “ламаного” циліндру, тобто:
 (5.35)
(5.35)
Якщо врахувати власний хаотичний рух всіх інших молекул окрім даної молекули А, то у цю формулу треба ввести поправковий коефіцієнт, який становить 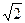 і показує, що реально зіткнень при цьому стане більше. Отже, остаточно маємо:
і показує, що реально зіткнень при цьому стане більше. Отже, остаточно маємо:
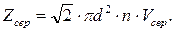 (5.36)
(5.36)
Тепер можна визначити середню довжину вільного пробігу молекул lсер, як відношення середнього шляху, що молекула проходить за 1 с (а це її Vcep), до середньої кількості її зіткнень з іншими Zcep за 1 с, тобто:
 (5.37)
(5.37)
Із цієї формули випливає, що lсер не залежить від температури газу, оскільки при її підвищенні зростають і середня швидкість молекул Vcep, і кількість зіткнень Zcep. Для даного газу при незмінній температурі lсер обернено пропорційна концен-трації його молекул n, а враховуючи співвідношення (5.18), обернено пропорційнаі його тиску р.
При зіткненнях молекули можуть наближатись до деякої найменшої відстані sеф, яку називають ефективним діаметром молекули. Якщо покласти, що sеф = d, то із попередньої формули отримаємо:
 (5.38)
(5.38)
Очевидно, що при збільшенні температури газу, інтенсивність руху його молекул збільшується, тому при зіткненнях центри молекул сильніше зближаються. Отже, при цьому ефективний діаметр молекул sеф зменшується. Останні два співвідношення використовують для розрахунків ефективного діаметру молекул газів, довжини їхнього вільного пробігу lсер або концентрації молекул n.
Якщо із посудини відкачувати газ, то при зниженні його тиску кількість зіткнень молекул між собою зменшується, що призводить до збільшення їхньої довжини вільного пробігу. При досить великому розрідженні зіткнення молекул між собою стають відносно рідкими, а основну роль починають відігравати зіткнення молекул зі стінками посудини. Стан газу, при якому середня довжина вільного пробігу молекул lсер стає порівняльною або більшою за лінійні розміри посудини d, у якій він знаходиться, називають вакуумом. В залежності від співвідношення між lсер та d, розрізняють низький (lсер < d), середній (lсер» d), високий (lсер > d) і надвисокий (lсер >> d) вакуум. Питання створення вакууму має велике значення в техніці, оскільки, наприклад, у багатьох сучасних електронних приладах використовують електронні пучки, формування яких можливе лише за умов вакууму. Для одержання різних ступенів розрідження газів застосовують вакуумні насоси.
Хаотичний тепловий рух молекул, безперервні зіткнення між ними приводять до того, що молекули, хоч і досить повільно, переміщуються із однієї точки простору у іншу. В результаті зіткнень змінюються модулі і напрямки швидкостей молекул, що спричиняє передачу імпульсу і енергії. Тому, якщо розглядати нескінченно малі об¢єми окремих ділянок газового середовища, самодовільно вникають флуктуації густини (концентрації), температури і тиску газу, які миттєво зникають. Якщо ці неоднорідності спричинені стороннім джерелом і мають сталий характер, то хаотичний рух молекул намагається їх ліквідувати. При цьому в газі виникають явища переносу - особливі необоротні процеси у термодинамічно нерівноважних системах, в результаті яких відбувається просторовий перенос енергії, маси або імпульсу. До них відносяться дифузія, внутрішнє тертя (в¢яз-кість) та теплопровідність.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 3427; Нарушение авторских прав?; Мы поможем в написании вашей работы!