
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кількість речовини
|
|
|
|
Параметри газів
1. Яка фізична величина визначається фразою “...є мірою середньої кінетичної енергії молекул системи”?
а) Кількість теплоти. б) Теплоємність. в) Теплотворна здатність.
г) Температура. д) Питома теплоємність.
2. Яка фізична величина характеризує стан термодинамічної рівноваги макроскопічної системи та визначає напрямок теплообміну між тілами? Дайте їй визначення.
а) Тиск. б) Об’єм. в) Температура. г) Густина. д) Концентрація молекул.
3. Яке із висловлювань є вірним? Поясніть.
а) При підвищенні тиску газу інтенсивність руху його молекул збільшується.
б) Температура газу не впливає на інтенсивність руху його молекул.
в) При абсолютному нулі поступальний рух молекул газу найінтенсивніший.
г) При підвищенні температури, тиск газу на стінки посудини зменшується.
д) При абсолютному нулі поступальний рух молекул газу припиняється.
4. Яка температура прийнята за нуль градусів за шкалою Цельсія?
а) Температура кипіння води. г) Середня кімнатна температура.
б) Температура танення льоду д) -273,160C.
в) Температура, при якій густина води дорівнює одиниці.
5. Яку температуру називають “ абсолютним нулем” Т 0? Що вона означає?
а) Т 0=–1000 С. б) Т 0=00 С. в) Т 0=–2730 С. г) Т 0=-1960 С. д) Т 0=–2690С.
6. Яким співвідношенням зв¢язані значення температури за Термодинамічною шкалою Кельвіна Т (K) і за Міжнародною практичною шкалою Цельсія t (0 C)?
а) T= 273- t 0 С. б) T= 273× t 0 C. в) T+t 0 C =273. г) T= 273+ t 0 C. д) T=t0C.
7. Укажіть одиницю виміру тиску газу р. Дайте визначення цієї величини.
а) Паскаль. б) Ампер. в) Кельвін. г) Ньютон. д) Джоуль.
8. У чому полягає фізичний зміст сталої Авогадро?
|
|
|
а) Кількість молекул у 1 кг речовини. г) Кількість молекул у 1 г речовини.
б) Кількість молекул у 1 м3 речовини. д) Кількість молекул 1 молі речовини.
в) Кількість молекул у 1 літрі речовини.
9. Укажіть вірну розмірність для сталої Авогадро. Дайте їй визначення.
а) [моль]. б) [моль/К]. в) [моль-1]. г) [К/моль]. д) [Па/с].
10. Укажіть вірний вираз для визначення сталої Больцмана k= 1,38×10-23. (R - молярна газова стала, NA – стала Авогадро).
а) k=R+NA. б) k=R/NA. в) k=NA/R. г) k=R×NA. д) k= (NA) R.
11. Укажіть вірну розмірність для сталої Больцмана.
а) [Дж/К]. б) [Н/м]. в) [Па/К]. г) [Н/К]. д) [Дж×К].
12. У резервуарі об'ємом V =20 м3 міститься N =5×103 молекул газу. Визначте концентрацію молекул цього газу n.
а) n= 4×10-3 м-3. б) n= 1×105 м-3. в) n= 7,5×104 м-3. г) n= 2,5×102 м-3. д) n= 5×103 м-3.
13. Яка із перелічених частинок є найменшою частинкою речовини, яка зберігає її хімічні властивості?
а) Атом. б) Електрон. в) Протон. г) Іон. д) Молекула.
14. Один моль будь-якої речовини містить, за означенням, однакову кількість атомів (молекул), яка називається числом (або сталою):
а) Авогадро. б) Больцмана. в) Планка. г) Пуассона. д) Клаузіуса.
15. Що показує число (стала) Авогадро?
а) Число молів у масі m речовини. г) Число електронів у 1 молі речовини.
б) Число молекул у 1 молі речовини. д) Число молекул у масі m =1 г речовини.
в) Число молекул у об'ємі V= 1 м3 речовини.
16. За якою формулою можна визначити молярну масу газу М? (m 0 – маса молекули газу, N – загальна кількість молекул, NA – число Авогадро, m – загальна маса газу).
а) 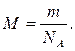 б)
б) 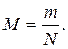 в) М=m 0 ×NА. г)
в) М=m 0 ×NА. г)  д)
д) 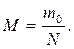
17. Яка кількість молекул N міститься у кількості ν =1 молі речовини?
а) N= 1,6·10-19. б) N= 8,31·103. в) N= 1,38·10-23. г) N= 6,02·1023. д) N= 9,11·10-31.
18. Які об¢єми займають кількості ν =1 моль будь-яких газів при однакових температурі Т та тиску р?
а) Різні об’єми. б) Однакові об’єми. в) Об’єм V= 22,4 л.
|
|
|
г) Об’єм V= 1 м3. д) Об’єми пропорційні молярним масам.
19. За якою формулою можна визначити загальну кількість речовини n?
а) ν=N/NA. б) ν=N+NA. в) ν=N–NA. г) ν=N×NA. д) ν=NA/N.
20. За якою формулою можна визначити загальну кількість молекул газу у посудині N?(m – маса газу, М – його молярна маса, NA – число Авогадро, n – концен-трація молекул газу).
а) 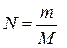 . б)
. б)  . в)
. в) 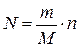 . г)
. г)  . д)
. д)  .
.
21. Яка формула визначає кількість речовини n у макроскопічному тілі? (m – маса тіла, М – молярна маса, NA – число Авогадро, N – кількість молекул в цьому тілі, V – об‘єм тіла).
а) 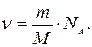 б)
б) 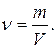 в)
в)  г)
г)  д)
д) 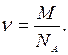
22. Якою є одиниця виміру кількості речовини?
а) Безрозмірна величина. б) [ кг ]. в) [ моль ]. г) 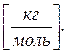 д)
д) 
23. В посудині міститься N= 3,6×1027 молекул газу. Скільки кіломолів n складає ця кількість газу у посудині? (Стала Авогадро NA =6×1023 моль-1).
a) n= 0,01 кмоль. б) n= 0,6 кмоль. в) n= 6 кмоль. г) n= 24 кмоль. д) n= 120 кмоль.
24. В посудині міститься N= 8,4×1028 молекул газу. Скільки кіломолів складає ця кількість газу у посудині? (Стала Авогадро NA =6×1023 моль-1).
а) n= 36 кмоль. б) n= 140 кмоль. в) n= 18 кмоль. г) n= 72 кмоль. д) n= 180 кмоль.
25. Скільки молів n міститься у масі m =1 кг водню? Молярна маса водню М =2×10-3 кг/моль.
а) n= 500 моль. б) n= 50 моль. в) n= 15 моль. г) n= 150 моль. д) n= 1500 моль.
26. Яка кількість речовини n міститься у алюмінії масою m =5,4 кг? (Молярна маса алюмінію М =27×10-3 кг/моль).
а) n =250 моль. б) n =100 моль. в) n =150 моль. г) n =50 моль. д) n =200 моль.
27. Скільки молів n міститься у масі m =1,44 кг кисню? (Молярна маса кисню М = =0,032×кг/моль).
а) n= 30 моль. б) n= 75 моль. в) n= 90 моль. г) n= 45 моль. д) n= 60 моль.
28. Визначити масу m кількості n= 50 моль вуглекислого газу, молярна маса якого М =44×10-3 кг/моль.
а) m= 12 кг. б) m= 5,4 кг. в) m= 1,6 кг. г) m= 0,8 кг. д) m= 2,2 кг.
29. Чому дорівнює маса m кількості n= 30 моль метану? (Молярна маса метану М = =16×10-3 кг/моль).
а) m= 480 г. б) m= 2,2 кг. в) m= 5,8 кг. г) m= 21 кг. д) m= 64 г.
30. Чому дорівнює маса m кількості n= 20 моль аміаку NH 3? (Молярна маса аміаку М =17×10-3 кг/моль).
а) m= 1,7 кг. б) m= 0,92 кг. в) m= 0,34 кг. г) m= 0,17 кг. д) m= 3,4 кг.
31. Який об’єм V займає кількість n= 100 молів ртуті? (Молярна маса ртуті М =0,2 кг/моль, а її густина r =13,6×103 кг/м3).
а) V =1 л. б) V =1,5 л. в) V =5 л. г) V =0,1 л. д) V =15 л.
|
|
|
32. Скільки молекул N знаходиться у масі m= 1 г вуглекислого газу СО 2? (Молярна маса вуглекислого газу М =44×10-3 кг/моль, стала Авогадро NA =6×1023 моль-1).
а) N= 2,6×1023. б) N= 5,2×1022. в) N= 4,8×1021. г) N= 8,6×1024. д) N= 1,4×1022.
33. Визначте, скільки молекул N міститься у масі m= 2 г водяної пари? (Молярна маса водяної пари М =18×10-3 кг/моль, стала Авогадро NA =6×1023 моль-1).
а) N= 6,7×1022. б) N= 2,4×1023. в) N= 8,1×1021. г) N= 3,6×1024. д) N= 7,2×1020.
34. Визначте, скільки атомів водню N міститься у масі m= 18 г води, якщо її молярна маса М =18×10-3 кг/моль? (Стала Авогадро NA =6×1023 моль-1).
а) N= 4,8×1022. б) N= 6,0×1023. в) N= 6,4×1021. г) N= 9,6×1020. д) N= 1,2×1024.
35. Визначте кількість атомів N у алюмінії масою m =135 г, молярна маса якого М = =27×10-3 кг/моль. (Стала Авогадро NA =6×1023 моль-1).
а) N= 5×1022. б) N= 1×1021. в) N= 3×1024. г) N= 9×1023. д) N= 7×1020.
36. Скільки молекул N міститься у масі m =34 г аміаку NH 3? (Молярна маса аміаку М =17×10-3 кг/моль, стала Авогадро NA =6×1023 моль-1).
а) N =6,4·1023. б) N =1,2·1024. в) N =2,4·1025. г) N =3,2·1021. д) N =4,8·1022.
37. Скільки атомів водню N міститься у масі m =34 г аміаку? (Молярна маса аміаку М =17×10-3 кг/моль, стала Авогадро NA =6×1023 моль-1).
а) N= 9,1×1020. б) N =4,2·1023. в) N =5,6·1021. г) N =2,4·1022. д) N= 3,6×1024.
38. У резервуарі об'ємом V =8 м3 міститься N =4×1017 молекул газу. Визначте концентрацію n молекул цього газу.
а) n= 9 1019 м-3. б) n= 7 1021 м-3. в) n= 4 1020 м-3. г) n= 5 1018 м-3. д) n= 2 1017 м-3.
39. Визначте масу m 0 однієї молекули вуглекислого газу, молярна маса якого М = =44×10-3 кг/моль. (Стала Авогадро NA =6×1023 моль-1).
а) m 0=3,6·10-25 кг. б) m 0=7,3·10-26 кг. в) m 0=3,6·10-23 кг.
г) m 0=8,1·10-24 кг. д) m 0=4,2·10-21 кг.
40. Скільки молекул повітря N міститься в аудиторії, розмірами V =8´6´4 м3, при температурі Т= 295 К і тиску р =10 Па? (Стала Больцмана k= 1,38×10-23 Дж/К).
а) N =4,7·1027. б) N =2,5·1024. в) N =6,4·1026. г) N =7,8·1025. д) N =4,2·1028.
41. Визначте масу m 0 однієї молекули води, молярна маса якої М =18×10-3 кг/моль. (Стала Авогадро NA =6×1023 моль-1).
а) m 0=7·10-24 кг. б) m 0=2·10-27 кг. в) m 0=3·10-26 кг. г) m 0=6·10-23 кг. д) m 0=8·10-25 кг.
|
|
|
42. Визначте масу m 0 однієї молекули метану CH 4, молярна маса якого М =16 10-3 кг/моль. (Стала Авогадро NA =6×1023 моль-1).
а) m 0=3,6·10-24 кг. б) m 0=1,8·10-25 кг. в) m 0=6,3·10-28 кг.
г) m 0=2,7·10-26 кг. д) m 0=4,2·10-27 кг.
43. Скільки молекул N знаходиться у масі m =1 г аміаку NH 3, молярна маса якого М =17×10-3 кг/моль? (Стала Авогадро NA =6×1023 моль-1).
a) N =2,8×1025. б) N =7,4×1023. в) N =4,6×1026. г) N =1,2×1024. д) N =3,5×1022.
44. Яка кількість речовини n міститься у залізі масою m= 11,2 кг? (Молярна маса заліза М =56×10-3 кг/моль).
а) n =200 моль. б) n =100 моль. в) n =50 моль. г) n =150 моль. д) n =10 моль.
45. Визначити, скільки атомів N міститься у об¢ємі V =1 см3 свинцю? (Молярна ма-са свинцю M =207×10-3 кг/моль, а густина r= 11,3 г/см3).
а) N =7,4×1024. б) N =3,3×1022. в) N =6,8×1025. г) N =2,1×1023. д) N =4,6×1026.
46. Скільки кіломолів газу n міститься у балоні об'ємом V =10 м3, якщо при температурі T =400 К манометр показує тиск p =830 кПа? (Молярна газова стала R = =8,31 Дж/моль∙К).
а) n =3,5 кмоль. б) n =5 кмоль. в) n =7,5 кмоль. г) n =2,5 кмоль. д) n =1,5 кмоль.
47. Газ міститься в балоні об'ємом V =10 л під тиском p =49,8 МПа при температурі T =600 К. Скільки молів n становить ця кількість газу? (Молярна газова стала R = =8,31 Дж/моль∙К).
а) n =250 моль. б) n =150 моль. в) n =100 моль. г) n =50 моль. д) n =200 моль.
48. Скільки молів газу n міститься в балоні об'ємом V =6 м3, якщо при температурі T =300 К манометр показує тиск p =480 кПа? (Молярна стала R =8,31 Дж/моль К).
а) n =300 моль. б) n =900 моль. в) n =600 моль. г) n =100 моль. д) n =1200 моль.
49. Газ міститься в балоні об'ємом V =8 л під тиском p =24 МПа при температурі T= = 500 К. Скільки молів n становить ця кількість газу? (Молярна газова стала R = =8,31 Дж/моль∙К).
а) n =92 моль. б) n =23 моль. в) n =12 моль. г) n =46 моль. д) n =69 моль.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 1538; Нарушение авторских прав?; Мы поможем в написании вашей работы!