
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
И энергии Гиббса образования DfG0 некоторых веществ
|
|
|
|
| Вещество | D H 0, кДж/моль | S 0, Дж/моль×К | D G 0, кДж/моль |
| Al(OH)3 (аморф.) | - | - | -1143,0 |
| BaO (к) | -553,9 | 70,5 | -525,4 |
| BaCO3 (к) | -1210,85 | 112,13 | -1132,77 |
| BeO (к) | -598,73 | 14,14 | -569,94 |
| BeCO3 (к) | -982 | 67,29 | -944,7 |
| C (графит) | 5б74 | ||
| C (алмаз) | 1.828 | 2,37 | 2,834 |
| C2H2 (газ) | 226,75 | 200,82 | 209,21 |
| C2H4 (г) | 52,3 | 219,4 | 68,1 |
| C2H5OH (ж) | -277,6 | 160,7 | -174,8 |
| CH3COOH (ж) | -487,0 | 159,8 | -382,4 |
| C3H8O3(ж) | -668,60 | 204,47 | -477,07 |
| C6H12O6(к) глюкоза | -1273,0 | - | -919,5 |
| C12H22O11(к) сахароза | -2222,12 | 360,24 | -1544,70 |
| CaO (к) | -635,5 | 39,7 | -604,2 |
| CaCO3 (к) | -1207,0 | -88,7 | -1129,6 |
| CO (г) | -110,5 | 197,5 | -137,1 |
| CO2 (г) | -393,5 | 213,7 | -394,4 |
| CO(NH2)2 (к) | -332,88 | 104,5 | -196,82 |
| O2 (г) | 205,0 | ||
| CuO (к) | -162,0 | 42,6 | -129,9 |
| Fe3O4 (к) | -1117,1 | 146,2 | -1014,2 |
| H2 (г) | 130,5 | ||
| H2O (г) | -241,8 | 188,7 | -228,6 |
| H2O (ж) | -285,8 | 70,1 | -237,23 |
| H2O (к) | -291,85 | (39,33) | - |
| H2O2 (ж) | -187,0 | 110,0 | -120,0 |
| HCl (г) | -92,3 | 186,8 | -95,3 |
| NH3 (г) | -45,94 | 192,6 | -16,48 |
| N2O (г) | 82,01 | 219,83 | 104,12 |
| NO (г) | 91,26 | 210,64 | 87,58 |
| P4O10 (к) | -2984,03 | 228,86 | -2697,6 |
Пример 1. С помощью термохимического уравнения:
H2S(г) + 3/2 O2(г) = SO2(г) + H2O(г) + 562,8 кДж
определите объем сгоревшего сероводорода, если известно, что в результате реакции выделилось 281,4 кДж теплоты.
Решение:
Проведем расчет по уравнению реакции и определим объем H2S:
x л 281,4 кДж
H2S(г) + 3/2 O2(г) = SO2(г) + H2O(г) + 562,8 кДж..
22,4 л
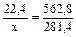 , отсюда x = V (H2S)=11,2 л. Ответ: V (H2S)=11,2 л.
, отсюда x = V (H2S)=11,2 л. Ответ: V (H2S)=11,2 л.
Пример 2. Вычислите тепловой эффект реакции:
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(ж)
при стандартных условиях, пользуясь справочными значениями стандартных энтальпий образования веществ (табл. 3).
Решение: По закону Гесса:
D H 0хим.р-ции = ∑ni D fH 0п.род. – ∑nj D fH 0исх.;
D H 0хим.р-ции =[4D fH0 (NO(г)) + 6D fH 0(H2O(ж))] – [4D fH 0(NH3(г)) + 5D fH 0(O2(г))]=[4∙51 + 6∙(– 286)] – [ 4∙(– 46) + 5∙0]= – 1168 кДж/моль
 Ответ: Так как D H 0хим.р-ции < 0, то Q = +1168 кДж/моль, т.е. процесс экзотермический.
Ответ: Так как D H 0хим.р-ции < 0, то Q = +1168 кДж/моль, т.е. процесс экзотермический.
Пример 3. Определите калорийность 350 г пищевого продукта, содержащего 50 % воды, 30 % белка, 15 % жиров и 5 % углеводов.
|
|
|
Решение:
m (белка)=350×0,30=105 г; m (углевод.)=350×0,05=17,5 г; m (жиров)=350×0,15=52,5 г.
Калорийность белков и углеводов составляет 17,1 кДж/моль калорийность жиров - 38 кДж/моль.
Калорийность пищевого продукта равна:
105×17,1 + 17,5×17,1 + 52,5×38,0 = 4089,75 кДж или
4089,75:4,18 = 978,4 ккал.
Ответ: калорийность 350 г пищевого продукта составляет 4089,75 кДж или 978,4 ккал.
Пример 4. Рассчитайте энтальпию гидратации Na2SO4, если известно, что энтальпия растворения безводной соли Na2SO4(к) равна
–2,3 кДж/моль, а энтальпия растворения кристаллогидрата Na2SO4×5H2O(к) равна +78,6 кДж/моль.
Решение: При растворении безводной соли происходит ее гидратация и последующее растворение кристаллогидрата в воде. Эти процессы могут быть выражены энтальпийной диаграммой и следующими термодинамическими уравнениями:
Na2SO4(к) + 10H2O(ж) = Na2SO4×10H2O(ж); D H 1=?
Na2SO4×10H2O(к)+ H2O(ж) = Na2SO4(р-р); D H 2= +78,6 кДж/моль

|
Na2SO4(к)+ H2O(ж) = Na2SO4(р-р); D H 3= -2,3 кДж/моль
В соответствии с законом Гесса энтальпия процесса растворения безводной соли (D H 3) равна сумме энтальпий гидратации безводной соли до кристаллогидрата (D H 1) и энтальпии растворения кристаллогидрата (DH2):
D H 3 =D H 1 + D H 2.
Поэтому энтальпия гидратации Na2SO4 будет равна:
D H 1=D H 3 - D H 2=-2,3 - 78,6=-80,9 кДж/моль.
Ответ: энтальпия гидратации Na2SO4 равна -80,9 кДж/моль.
Пример 5. В каком состоянии (кристаллическом или парообразном) энтропия 1 моль вещества больше при одинаковой температуре?
Решение: Энтропия есть мера неупорядоченности состояния вещества. В кристалле частицы (атомы, ионы) расположены упорядоченно и могут находиться лишь в определенных точках пространства, а для газа таких ограничений нет. Объем 1 моль газа гораздо больше объема 1 моль кристаллического вещества; возможность хаотичного движения молекул газа больше. Поскольку энтропию можно рассматривать как количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия 1 моль паров вещества больше энтропии 1 моль его кристаллов при одинаковой температуре.
|
|
|
Пример 6. Вычислите энергию Гиббса (D G 0хим.р-ции) следующих реакций при стандартной температуре:
1) 2H2(г) +O2(г) = 2H2O(г);
2) 2SO2(г) + O2(г) = 2SO3(г);
3) 6CO2(г) + 6H2O(г) = C6H12O6(к0 + 6O2(г).
Как изменится D G 0хим.р-ции при повышении температуры?
Решение: Энергии Гиббса приведенных реакций можно вычислить с использованием справочных значений энтальпий образования веществ и энтропии. Как правило, значения D H0 приводятся в кДж/моль, а  D S 0 – в Дж/(моль×К).
D S 0 – в Дж/(моль×К).
2H2(г) +O2(г) = 2H2O(г)
D fH 0, кДж/моль 0 0 2×(-241,8)
D H 0хим.р-ции=2×(-241,8) -0 = -483,6 кДж/моль. 
S 0, Дж/(моль×К) 2×(130,5) 205,0 2×(188,7)
D S 0хим.р-ции = 2×(188,7) – [2×(130,5) + 205,0] = -88,7 Дж/К;
D G 0хим.р-ции = D H 0хим.р-ции - T ×D S 0хим.р-ции = – 483,6 – 298∙(– 88,7) =
= – 457,2 кДж.
Если имеются значения энергий Гиббса образования веществ, то можно провести расчет с их использованием. В данном случае D G 0хим.р-ции =2×D fG 0 (H2O(г)), так как D G 0 для простых веществ равна нулю.
Для реакции (2) проведем расчет энергии Гиббса с использованием справочных значений D fG 0 веществ:
2SO2(г) + O2(г) = 2SO3(г);
D fG 0, кДж/моль: 2×(-300,2) 0 2×(-371,1)
D G 0хим.р-ции = 2×(-371,1) – 2×(-300,2) = -141,8 кДж.
Распространенной ошибкой является представление о том, что если D G 0хим.р-ции < 0, то соответствующий процесс обязательно протекает. Например, в случае реакции (1) D G 0хим.р-ции << 0, но несмотря на это при комнатной температуре водород и кислород практически не взаимодействуют. При 1000 0С происходит энергичное взаимодействие: взрыв гремучего газа. Реакцию (2) практически невозможно провести ни при комнатной температуре, ни при 10000С, так как при комнатной температуре мала скорость реакции, а при 1273К D G 0хим.р-ции > 0. Этот вывод справедлив, если все вещества в смеси находятся в стандартном состоянии.
Задачи для самостоятельного решения
61. Рассчитайте изменение энтальпии D H 0 в процессе усвоения в организме человека сахарозы, который сводится к ее окислению:
C12H22O11 (к) + 12O2 (г) = 12CO2 (г) + 11H2O(ж),
используя данные табл. 4. Поясните полученный результат.
(Ответ: – 5643,68 кДж)
62. Вычислите значение энтальпии D H 0 для протекающих в организме реакций превращения глюкозы:
а) C6H12O6 (к) + 6O2 (г) = 6CO2 (г) + 6H2O (ж);
|
|
|
б) C6H12O6 (к) = 2C2H5OH (ж) + 2CO2 (г).
Какая из реакций даст организму больше энергии?
(Ответ: а) –2803 кДж; б) –69,2 кДж)
63. Рассчитайте тепловой эффект Q процесса образования из аммиака и углекислого газа мочевины – одного из важнейших продуктов жизнедеятельности организмов:
2NH3 (г) + CO2 (г) = CO(NH)2 (г) + H2O (ж),
используя данные табл. 4. Поясните полученный результат.
(Ответ: +132,78 кДж)
64. В организме человека этанол окисляется в две стадии: до уксусного альдегида (D H 01= – 256 кДж/моль), а затем до уксусной кислоты (D H 02= – 237 кДж/моль):
C2H5OH(ж) 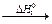 CH3COH (ж)
CH3COH (ж) 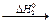 CH3COOH (ж).
CH3COOH (ж).
На основании закона Гесса рассчитайте D H 0 реакции окисления этанола до уксусной кислоты. (Ответ: –493 кДж)
65. В 100 г трески в среднем содержится 11,6 г белков и 0,3 г жиров. Рассчитайте (в кДж и ккал) энергию, которая выделится при усвоении порции трески массой 228 г. Калорийность белков 17,1 кДж/г, а жиров – 38,8 кДж/г. (Ответ: 478,8 кДж; 114,5 ккал)
66. Определите тепловой эффект Q реакции синтеза диэтилового эфира, применяемого в медицине для наркоза, при 298К:
2C2H5OH(ж) = C2H5OC2H5 (ж) + H2O(ж),
если известны стандартные энтальпии сгорания веществ, участвующих в реакции:
D H 0сгорания (C2H5OC2H5 (ж))= -2727 кДж/моль,
D H 0сгорания (C2H5OH(ж))= -1371 кДж/моль,
D H 0сгорания (H2O(ж))=0 кДж/моль.
(Ответ: +15 кДж/моль)
67. Теплота растворения CuSO4 составляет +66,1 кДж/моль, а теплота гидратации
CuSO4(к) +5H2O(ж) = CuSO4×5H2O(к)
равна +78,8 кДж/моль. Вычислите теплоту растворения CuSO4×5H2O. (Ответ: -11,7 кДж/моль)
68. Рассчитайте энтальпию D H 0 гидратации карбоната натрия, если известно, что энтальпия растворения безводной соли Na2CO3(к) равна
–27,33 кДж/моль, а энтальпия растворения кристаллогидрата Na2CO3×10H2O составляет + 66,94 кДж/моль.
(Ответ: –101,33 кДж/моль)
69. Каков характер изменения энтропии (увеличение или уменьшение) при: а) синтезе воды из простых веществ; б) разложении воды на простые вещества? Запишите термохимические уравнения указанных реакций. Ответ подтвердите расчетом, выполненным с использованием данных табл. 4.
(Ответ: 2095 Дж/моль∙К)
70. Уменьшится или увеличится энтропия D S0 при переходах: а) воды в пар, б) воды в лед, в) графита в алмаз? Почему? Вычислите D S0 для каждого превращения, используя данные табл. 4.
|
|
|
(Ответ: а) 118,6, б) – 30,77, в) – 3,37 Дж/моль∙К)
71. Вычислите изменение энтропии при испарении 250 г воды при 25 0С, если стандартная энтальпия испарения 1 моль воды равна 41 кДж. (Ответ: 1911 Дж/К)
72. Глицерин - один из продуктов метаболизма превращается в организме окончательно в CO2(г) и H2O(ж). Вычислите D G 0 реакции окисления глицерина, используя данные табл. 4. Поясните полученный результат. (Ответ: –1655,05 кДж/моль)
73. Рассчитайте, используя данные табл. 4, изменение энергии Гиббса D G 0 для реакции:
4P (т) + 5CO2 (г) = P4O10 (т) + 5C (т).
Можно ли потушить горящий фосфор углекислым газом? Ответ поясните. (Ответ: –725,6 кДж/моль)
74. Оксид азота (I) применяется в медицине в качестве наркотического средства. Нет ли угрозы, что N2O(г) будет окисляться кислородом воздуха до весьма токсичного оксида азота (II): N2O (г) + O2 (г) = 4NO (г)? Дайте ответ на основании вычисления энергии Гиббса D G 0 с использованием данных табл. 4.
(Ответ: 142,08 кДж/моль)
75. Вычислите изменение энергии Гиббса D G 0 для приведенных ниже реакций, используя данные табл. 4:
а) Fe3O4 (к) + 4CO (г) = 3Fe (т) + 4CO2 (г);
б) C2H4 (г) + H2O (ж) = C2H5OH (ж).
Могут ли они протекать самопроизвольно в стандартных условиях? Какое практическое значение имеют эти реакции?
(Ответ: а) –15 кДж/моль, б) –5,27 кДж/моль)
76. Вычислите изменение энергии Гиббса D G 0 для приведенных ниже реакций, используя данные табл. 4:
а) 2H2O2 (ж) = 2H2O (ж) + O2 (г);
б) С(графит) + 1/2O2(г) = CO (г);
в) CuO (к) + H2 (г) = Cu (к) + H2O (г).
Могут ли они протекать самопроизвольно в стандартных условиях? Какое практическое значение имеют эти реакции?
(Ответ: а) –234,6; б) 137,1; в) –98,7 кДж/моль)
77. Будет ли алюминий взаимодействовать с водой, и нет ли опасности, что изделия из алюминия, широко применяемые в быту и медицинской технике, будут разрушаться под действием воды? Дайте ответ по результатам вычисления энергии Гиббса D G 0 прямой реакции с использованием данных табл. 4:
2Al (т) +6H2O (ж) = 3H2 (г) + 2Al(OH)3 (аморф.)
(Ответ: –862,62 кДж/моль)
78. Какие из карбонатов: а) BeCO3, б) CaCO3 или в) BaCO3 можно получить по реакции взаимодействия соответствующих оксидов с CO2? Какая реакция будет идти наиболее энергично? Сделайте вывод на основании результатов вычисления D G 0 реакций с использованием данных табл. 4.
(Ответ: а) 19,64; б) –131,0; в) –168,43 кДж/моль)
79. Реакция горения ацетилена протекает по уравнению:
C2H2 (г) + 5/2O2 (г) = 2CO2 (г) + H2O (ж).
Вычислите D G 0 и D S 0 реакции и объясните уменьшение энтропии в результате ее протекания.
(Ответ: –631,63 кДж/моль; –204,57 Дж/моль×К)
80. Используя данные табл. 4, рассчитайте энергию Гиббса D G 0 реакций:
а) NH3(г) + 3/2Cl2(г) = 1/2N2(г) + 3HCl(г);
б) NH3(г) + 3/4O2(г) = 1/2N2(г) + 3/2H2O(ж).
Сравните окислительные свойства хлора и кислорода по отношению к аммиаку. (Ответ: а) –78,82; б) –339,37кДж/моль)
Раздел 5
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 8424; Нарушение авторских прав?; Мы поможем в написании вашей работы!