
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 3. Смешаны равные объемы 0,01 моль/л раствора хлорида кальция и 0,02 моль/л раствора сульфата натрия
|
|
|
|
Смешаны равные объемы 0,01 моль/л раствора хлорида кальция и 0,02 моль/л раствора сульфата натрия. Образуется ли осадок сульфата кальция? 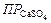 = 1,3·10-4.
= 1,3·10-4.
Решение: Найдем произведение концентраций ионов Ca2+ и SO42- в растворе, образовавшемся после смешивания, и сравним его с произведением растворимости сульфата кальция. Поскольку после смешивания исходных растворов CaCl2 и Na2SO4 общий объём раствора возрастает вдвое, то концентрации ионов Ca2+ и SO42- вдвое уменьшаются по сравнению с исходными. Таким образом,
[Ca2+] = 0,01/2 = 0,005 моль/л, [SO42-] = 0,02/2 = 0,01 моль/л.
Находим произведение концентраций ионов:
[Ca2+]∙[SO42-] = 0,005∙0,01 = 5∙10-5.
Найденное произведение концентраций ионов меньше произведения растворимости сульфата кальция (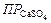 = 1,3∙10-4), следовательно, раствор будет ненасыщенным относительно CaSO4 и осадок не образуется. Ответ: не образуется.
= 1,3∙10-4), следовательно, раствор будет ненасыщенным относительно CaSO4 и осадок не образуется. Ответ: не образуется.
Пример 4. Во сколько раз уменьшится растворимость BaSO4 в растворе H2SO4 концентрации 0,1 моль/л по сравнению с его растворимостью в чистой воде? 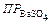 =1∙10-10.
=1∙10-10.
Решение: Растворимость BaSO4 в чистой воде составляет:
S (BaSO4) = [Ba2+] = [SO42-] =  = 1·10-5 моль/л.
= 1·10-5 моль/л.
Добавление BaSO4 к раствору серной кислоты увеличивает концентрацию одноименных ионов SO42-. Концентрацию ионов SO42- можно считать общей, поскольку она значительно больше концентрации SO42-.в растворе BaSO4. Концентрацию ионов Ba2+ в растворе серной кислоты, которая будет равна растворимости BaSO4 в этом растворе, обозначим S 1. Величина 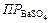 остаётся постоянной. Следовательно, произведение концентраций ионов Ba2+ и SO42- в растворе H2SO4 равно:
остаётся постоянной. Следовательно, произведение концентраций ионов Ba2+ и SO42- в растворе H2SO4 равно:
S 1∙0,1=1∙10-10, отсюда S 1=1∙10-11моль/л.
Таким образом, растворимость BaSO4 в растворе H2SO4 меньше, чем в чистой воде в S / S 1 = 1∙10-5/1∙10-11 = 106 раз.
Ответ: в 106 раз
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 8148; Нарушение авторских прав?; Мы поможем в написании вашей работы!