
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічна рівновага
Завдання для індивідуальної самостійної роботи
Обчислити, у скільки разів зросте швидкість реакції при підвищенні температури на Δt при значенні γ, наведеному у таблиці
| Варіант | Δt | γ | Варіант | Δt | γ |
При температурі 15 oC реакція перебігає за τ хв. Визначити час, за який реакція перебігає 25, 35, 45 oC. За умов наведених у таблиці:
| Варіант | γ | τ | Варіант | γ | τ |
| 2,5 | 12,5 | ||||
| 2,5 |
На скільки градусів треба підвищити температуру, щоб швидкість реакції зросла в nразів при даному значенні γ.
| Варіант | n | γ | Варіант | n | γ |
| 2,5 | |||||
| 2,5 | |||||
Деякі хімічні реакції бувають необоротні, тобто такими які завершуються цілковитим перетворенням вихідних реагуючих речовин в кінцеві продукти реакції. Відбуваються лише в одному напрямку.
Оборотні реакції не доходять до кінця і закінчуються встановленням хімічної рівноваги. Тобто, ті які можуть відбуватися в прямому і зворотному напрямках.
У рівняннях оборотних реакцій замість знака рівності ставлять знак оберненості (⇄). В рівняннях необоротних реакцій одну риску в знаку рівності замінюють стрілкою, яка вказує напрямок реакції.
Для кожної оборотної реакції існують умови, коли одночасно можуть відбуватися як пряма, так і зворотна реакції. Співвідношення швидкостей прямої і зворотної реакцій залежить від співвідношення концентрацій реагуючих речовин (закон діючих мас). У перший момент, коли змішали реагуючі речовини А і В, швидкість прямої реакції (v1) велика і визначається початковими концентраціями вихідних речовин:
nA + mB ⇄ xC + yD, тобто v 1 = k1 [А]n [В]m
а швидкість зворотної дорівнює 0. В міру взаємодії А і В і утворення С і D швидкість зворотної реакції (v2) зростатиме:
v2 = k2 [C]x [D]y
Через деякий час швидкості прямої і зворотної реакцій зрівняються: v1=v2
k1 [А]n [В]m = k2 [C]x [D]y
Звідки 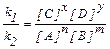 . При певній температурі константи швидкості прямої (k1) та зворотної (k2) реакцій є величини сталі, тому їх відношення k1 / k2 = К – є величина стала і називається константою хімічної рівноваги.
. При певній температурі константи швидкості прямої (k1) та зворотної (k2) реакцій є величини сталі, тому їх відношення k1 / k2 = К – є величина стала і називається константою хімічної рівноваги.

У виразі для константи хімічної рівноваги у чисельнику записують концентрації продуктів реакції, а у знаменнику – концентрації реагуючих речовин, причому беруть рівноважні концентрації. При цьому концентрації входять у степенях, що дорівнюють стехіометричним коефіцієнтам речовин у рівнянні реакції.
Таким чином, в оборотних реакціях рівновага настає тоді, коли добуток концентрацій утворених речовин поділений на добуток концентрацій вихідних речовин, дорівнює сталій величині при даній температурі.
Константа хімічної рівноваги визначає глибину протікання реакції на момент стану рівноваги. Чим більша величина К, тим повніше взаємодіють речовини.
Стан хімічної рівноваги при постійних умовах може зберігатися як завгодно довго. Однак при зміні умов рівноваги – температури, концентрації, тиску (для газоподібних речовин) – стан рівноваги порушується.
Загальний характер зміни рівноваги залежно від зовнішніх факторів може бути визначеним за принципом Ле Шательє: "Якщо на систему, що перебуває у рівновазі, подіяти зовнішнім фактором (температура, тиск, концентрація), то рівновага зміниться у напрямі процесу, який послаблює цю дію"
Якщо в системі, що знаходиться в стані хімічної рівноваги, змінити концентрацію хоча б однієї речовини, рівновага порушується, і концентрації всіх інших речовин також зміняться.
Із виразу константи хімічної рівноваги можна зробити наступні висновки.
1. Для того щоб найбільш повно використати у рівноважній реакції одну з речовин, потрібно діяти на неї надлишком іншої речовини.
2. Якщо один із продуктів буде виводитися із сфери реакції, рівновага буде зміщуватися в бік його утворення.
Для газоподібних систем на стан хімічної рівноваги впливає тиск, оскільки із збільшенням тиску зростає концентрація газоподібних компонентів.
Всі хімічні перетворення (реакції) супроводжуються енергетичними ефектами. Іноді останні мають важливіше значення, ніж продукти, що утворюються в процесі реакції.
Температура змінює швидкості прямої і зворотної реакцій, але не в однаковій мірі. Отже, зміна температури обумовлює зміну хімічної рівноваги. Напрямок, в якому відбувається зміна рівноваги під впливом температури, визначається законом Вант-Гоффа: " Якщо температура системи, що знаходиться в рівновазі, змінюється, то при підвищенні температури рівновага зміщується у бік процесу, що відбувається з поглинанням тепла (ендотермічного), а при зниженні - у зворотний бік (екзотермічного)".
|
|
Дата добавления: 2014-11-07; Просмотров: 532; Нарушение авторских прав?; Мы поможем в написании вашей работы!