
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розчини неелектролітів
|
|
|
|
Завдання для індивідуальної самостійної роботи
8.1 Розрахувати:
а) масову частку розчиненої речовини; б) молярну концентрацію;
в) молярну концентрацію еквівалента; г) титр.
Густини водних розчинів речовин див. у додатку А п.4.
| Ва-ріант | Розчинена речовина | Об’єм води, мл | Ва-ріант | Розчинена речовина | Об’єм води, мл | ||
| формула | маса, г | формула | маса, г | ||||
| H3PO4 | H2SO4 | ||||||
| KOH | NaOH | ||||||
| HNO3 | HCl | ||||||
| H2SO4 | H3PO4 | ||||||
| NaOH | KOH | ||||||
| HCl | HNO3 | ||||||
| H3PO4 | H2SO4 | ||||||
| KOH | NaOH | ||||||
| HNO3 | HCl | ||||||
| H2SO4 | H3PO4 | ||||||
| NaOH | H2SO4 | 0,98 | |||||
| HCl | NaOH | ||||||
| H3PO4 | HCl | 0,73 | |||||
| KOH | KOH | 1,12 | |||||
| HNO3 | HNO3 | 0,063 |
8.2 Розрахувати, який об’єм концентрованого розчину І потрібно узяти для приготування заданого об’єму розчину ІІ вказаної концентрації (густини водних розчинів деяких речовин див. у додатку А п.4.)
| Ва-ріант | Розчин I | Розчин II | ||
| речовина | концентрація | об’єм, л | концентрація | |
| H3PO4 | w = 10% | c ек = 0,1 моль/л | ||
| CaCl2 | c ек = 0,1 моль/л | T = 0,001 г/мл | ||
| AlCl3 | c ек = 0,1 моль/л | c = 0,01 моль/л | ||
| KOH | c = 2 моль/л | w = 4% | ||
| BaCl2 | T = 0,02 г/мл | c ек = 0,1 моль/л | ||
| CuSO4 | c ек = 0,2 моль/л | c = 0,05 моль/л | ||
| H2SO4 | w = 15% | w = 8% | ||
| Na2CO3 | c = 1,0 моль/л | T = 0,001 г/мл | ||
| Al(NO3)3 | c ек = 0,5 моль/л | c = 0,1 моль/л | ||
| NaOH | w = 5% | c ек = 0,09 моль/л | ||
| Ca(NO3)2 | T = 0,2 г/мл | c = 1,1 моль/л | ||
| CdCl2 | c = 0,1 моль/л | T = 0,001 г/мл | ||
| HCl | w = 20% | c ек = 0,1 моль/л | ||
| CoCl2 | c = 0,5 моль/л | c ек = 0,2 моль/л | ||
| CrCl3 | T = 0,01 г/мл | c = 0,01 моль/л | ||
| HNO3 | w = 20% | c = 0,01 моль/л | ||
| FeCl3 | c ек = 0,5 моль/л | T = 0,005 г/мл | ||
| K2CO3 | c = 0,05 моль/л | c ек = 0,03 моль/л | ||
| KOH | T = 0,2 г/мл | w = 10% | ||
| K2S | c ек = 4 моль/л | c = 0,5 моль/л | ||
| Mg(NO3)2 | c = 3 моль/л | c ек = 0,5 моль/л | ||
| H2SO4 | w = 96% | 10 000 | T = 0,01 г/мл | |
| Na2S | c ек = 2,5 моль/л | c = 0,5 моль/л | ||
| K2SO4 | c = 0,6 моль/л | c ек = 1 моль/л | ||
| NaOH | T = 0,1 г/мл | w = 5% | ||
| Сa3(PO4)2 | c ек = 12 моль/л | c = 0,5 моль/л | ||
| CaHPO4 | c ек = 12 моль/л | c = 0,5 моль/л | ||
| Сa(H2PO4)2 | c ек = 12 моль/л | c = 0,5 моль/л | ||
| AlPO4 | c ек = 12 моль/л | c ек= 0,5 моль/л | ||
| H2SO4 | w = 11% | w = 8% |
|
|
|
8.3 Розрахувати, який об’єм розчину І потрібно на взаємодію з розчином ІІ, враховуючи, що реакції перебігають з утворенням середніх (густини водних розчинів деяких речовин див. у додатку В).
| Ва-ріант | розчин I | розчин II | ||||
| речовина | концен-трація | речовина | маса речо-вини, г | концен-трація | об’єм роз-чину, мл | |
| Na2CO3 | 1,5 M | HCl | - | 4 н | ||
| AgNO3 | 0,1 н | AlCl3 | - | 0,1 М | ||
| HCl | 4 н | NaOH | - | - | ||
| H2SO4 | 0,5 М | KOH | - | 1 М | ||
| H3PO4 | 0,3 М | NaOH | - | 1 М | ||
| H2SO4 | 0,4 н | NaOH | - | - | ||
| Na2CO3 | 1,5 М | H2SO4 | - | 6% | ||
| AgNO3 | 0,01 н | HCl | - | 10% | ||
| Na2CO3 | 1 н | HNO3 | 18,9 | - | - | |
| AgNO3 | 5% | AlCl3 | - | 0,2 М | ||
| HCl | 10% | AgNO3 | - | 0,5 н | ||
| KOH | 0,5 н. | H3PO4 | - | 0,1 М | ||
| H2SO4 | 0,25 н. | Ca(OH)2 | 1,48 | - | - | |
| Al2(SO4)3 | 0,5 М | Ca(NO3)2 | - | 0,15 н | ||
| KOH | 0,2 н | FeCl3 | - | 0,5 М | ||
| H2SO4 | 4 н | K2CO3 | - | 20% (ρ=1,19) | ||
| H2SO4 | 10% | NaOH | - | - | ||
| HNO3 | 0,3 н | NaOH | - | - | ||
| NaOH | 0,2 н | FeCl3 | - | 0,2 М | ||
| HCl | 4% | AgNO3 | - | 0,02 н | ||
| H2SO4 | 15% | Mg(OH)2 | 11,6 | - | - | |
| Al2(SO4)3 | 0,05 н | NaOH | - | 0,15 н | ||
| Al(ОН)3 | 0,5 М | NaOH | - | 1,5 н | ||
| BaCl2 | 0,5 М | H2SO4 | - | 0,1 М | ||
| H2SO4 | 0,1 н | Na2CO3 | 4,24 | - | - | |
| ZnО | 0,5 % | NH4OH | - | 1,5 н | ||
| NaOH | 10% | H2SO4 | - | 0,1 М | ||
| HCl | 20% | Al(OH)3 | 15,6 | - | - | |
| СH3СОOН | 0,1 н | Na2CO3 | - | 0,02 н | ||
| NaOH | 0,2 н | H2SO4 | - | 0,1 М |
|
|
|
Всі хімічні речовини умовно поділяють на електроліти і неелектроліти. Критерієм такого розподілу є електропровідність їх розчинів або розплавів.
Речовини, розчини (розплави) яких проводять електричний струм, мають назву електролітів (кислоти, основи, солі).
Речовини, які в розчиненому (розплавленому) стані не проводять електричний струм, називаються неелектролітами (цукор, спирт, гліцерин та ін.).
Голландський хімік Вант-Гофф встановив закон осмотичного тиску: " Осмотичний тиск розчину чисельно дорівнює тиску, який чинила б розчинена речовина, якби вона при тій самій температурі перебувала в газоподібному стані і займала об'єм, що дорівнює об’єму розчину".
Математично закон Вант-Гоффа записується так:
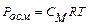
де Росм – осмотичний тиск; R – універсальна газова стала; Т – абсолютна температура; СМ – молярна концентрація.
За допомогою цього рівняння можна обчислювати осмотичний тиск розчинів неелектролітів, знаходити молекулярні маси розчинених речовин. Але слід враховувати, що закон Вант-Гоффа може бути застосований тільки для розведених розчинів.
Встановлено, що при розчиненні будь-якої нелеткої речовини у певному розчиннику тиск насиченої пари над розчином буде меншим, ніж тиск насиченої пари над чистим розчинником при сталій температурі. Цей факт обумовлений такими властивостями:
1) зменшенням ефективної поверхні випаровування розчину у порівнянні з чистим розчинником, оскільки частину поверхні розчину зайнято нелеткими молекулами розчиненої речовини;
2) взаємодією між молекулами розчиненої речовини і розчинника з утворенням гідратів (розчинник-вода) або сольватів (неводний розчинник), стійкіших, ніж з'єднання молекул розчинника між собою.
Якщо позначити тиск пари розчинника Ро, а тиск пари розчину – Р, то різниця Ро – Р = ΔР показує величину зниження тиску пари. Відношення цієї різниці до тиску пари розчинника дає так зване відносне зниження тиску пари розчинника:

Залежність зниження тиску пари розчинників над розчинами від їх концентрації вивчав французький хімік Рауль і відкрив наступний закон (1-й закон):
"Відносне зниження тиску насиченої пари розчинника над розчином дорівнює мольній частці розчиненої речовини".
|
|
|
Математичний вираз цього закону має такий вигляд
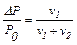
де ν1 і ν2 – відповідно кількість розчиненої речовини і розчинника, моль.
Всі чисті речовини характеризуються певними температурами замерзання і кипіння. Наявність розчиненої речовини підвищує температуру кипіння і знижує температуру замерзання розчинника тим сильніше, чим більш концентрований розчин.
Така залежність є прямим наслідком зниження тиску пари над розчинником. Таким чином, зміна температури кипіння розчину залежить від концентрації розчиненої речовини, із зростанням якої знижується тиск пари і підвищується температура кипіння розчину. Аналогічно пояснюється зниження температури замерзання розчинів.
Різниця між температурами кипіння розчину і чистого розчинника називається підвищенням температури кипіння розчину. Різниця між температурами замерзання чистого розчинника і розчину називається зниженням температури замерзання розчину:
Δtкип = t′ кип – tкип; Δtкр = tкр – t′ кр ,
де t′кип, t′зам, tкип, tзам – температури кипіння і кристалізації розчину і розчинника відповідно.
Таким чином, межі рідкого стану розчину розширені, порівняно з розчинником, на число градусів, що дорівнює сумі підвищення температури кипіння розчину і зниження температури його замерзання.
Розглянуті закономірності були встановлені Раулем:
2-й закон: "Для розведених розчинів підвищення температури кипіння і зниження температури замерзання пропорційні моляльніи концентрації розчинів".
3-й закон: "Розчини, що містять однакові кількості розчинених речовин в однакових кількостях розчинника, мають однакові зниження температур замерзання і однакові підвищення температур кипіння".
Зниження температури замерзання, що відповідає розчиненню 1 моль речовини в 1000 г розчинника (молекулярне зниження) є величина стала для даного розчинника і називається кріоскопічною сталою розчинника (Кк).
Молекулярне підвищення температур кипіння, тобто підвищення, яке спостерігається при розчиненні 1 моль речовини в 1000 г розчинника, називається ебуліоскопічною константою розчинника (КЕ).
|
|
|
Математичні вирази законів Рауля мають вигляд:
Δtкип = КЕ ∙Cm;
Δtкр =КK ∙Cm,
де Cm – моляльність; КЕ і КK – ебуліоскопічні та кріоскопічні сталі.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 920; Нарушение авторских прав?; Мы поможем в написании вашей работы!