
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ПО ОрганическОЙ химиИ
(часть 2)
Учебное пособие
Новосибирск 2011
УДК 547
ББК 24я7
К 60
Колчина Е.Ф., Бредихин Р.А.
Решаем задачи по органической химии: учеб. пособие в 3-х ч. / Новосиб. гос. ун-т. Новосибирск, 2010. Ч. 2. 80 С.
Учебное пособие состоит из трёх частей и содержит примеры заданий по органической химии, предлагавшиеся для решения учащимся СУНЦ НГУ на протяжении многих лет, теоретический материал, необходимый для их решения, а также примеры решения задач.
В первую часть пособия вошли шесть глав, посвящённые химии углеводородов. Первая глава – метод сожжения – посвящена вводной теме анализа органических веществ, с которой начинается изучение органической химии в СУНЦ НГУ. Главное внимание пособия уделено теме «Углеводороды», которая включает 5 глав, традиционно посвящённых различным классам углеводородов: алканам, алкенам, алкинам, алкадиенам и аренам.
Вторая часть пособия состоит из четырёх глав, в которых рассматриваются свойства кислородсодержащих соединений по классам: спирты (включая многоатомные спирты и фенолы), альдегиды и кетоны, карбоновые кислоты и их производные, углеводы. При изложении материала авторы регулярно обращались к более ранним разделам, с целью показать взаимосвязь, выявить аналогии в строении и химических свойствах органических веществ разных классов.
Третья часть пособия посвящена химическим свойствам азотсодержащих органических веществ, в том числе, простейших представителей гетероциклических соединений и основам ретросинтетического анализа.
Авторы выражают признательность и благодарность всем сотрудникам кафедры химии СУНЦ НГУ за ежедневную помощь в работе и тёплую атмосферу дружбы и сотрудничества.
Рецензент
к.х.н., доцент С.Г. Барам
© СУНЦ НГУ, 2010
© Колчина Е.Ф. Бредихин Р.А., 2011
От авторов
Органическая химия, по определению изучает соединения углерода, их строение и их превращения. Современные теоретические представления прочно внедрились в этот курс и даже несколько потеснили классическую описательную и синтетическую органическую химию. Курс органической химии в СУНЦ НГУ также уделяет повышенное внимание к теоретическим аспектам этой науки. Но порою складывается такая ситуация, что учащиеся, хорошо разбирающиеся в сложных теоретических вопросах, не могут решить простую расчетную задачу или затрудняются при разработке стратегии даже несложного органического синтеза.
Так возникла идея написания этого учебного пособия, в котором мы постарались показать, как применять те или иные теоретические знания для решения конкретных расчетных и синтетических задач.
С уважением,
Е.Ф.
Химия кислородсодержащих соединений тесно связана с понятием «функциональных групп», так как преимущественно представляет собой их взаимопревращения. Вместе с тем, на примере этих соединений хорошо прослеживается взаимосвязь «структура – свойства», что позволяет на основании анализа структурных особенностей соединения предсказывать его химические свойства. Более того, на основании простых рассуждений Вы можете придти к решению вопроса, какое из соединений обладает более выраженными кислотными свойствами или большей реакционной способностью в конкретном превращении. Решение и объяснение разнообразных задач развивает воображение, тренирует мышление, дисциплинирует логику, позволяет Вам формулировать Вашу собственную позицию в дискуссии и аргументировать свою точку зрения. Мы надеемся, что, проявив должные усидчивость, терпение и настойчивость, Вы овладеете логикой рассуждения органической химии и оцените красоту, изящество и элегантную целесообразность этой науки.
Почему я потратил время на то, чтобы подготовить данное пособие? Читатель, мне кажется полезным, чтобы Вы об этих причинах знали.
Честно говоря, мне скучно два раза проводить один и тот же семинар (и несколько лет подряд решать одни и те же задачи) – для меня каждое занятие должно быть «новым», поэтому я не могу быть хорошим учителем.
Ценность данного пособия для меня как преподавателя кафедры химии будет заключаться в том, что в нем изложены типовые задания, которые предлагаются учащимся ФМШ и приведены те типовые решения, которые мы хотели бы видеть от учащихся при решении ими контрольных работ. Иными словами, образец контрольной работы и её правильного решения.
Изложение материала в данной книге и его обсуждение с коллегами позволило мне найти новые приёмы проведения семинаров в нашей ФМШ.
Надеюсь также, что, вложив часть себя в издание данного пособия, я смогу в некоторых случаях переадресовать школьника к самостоятельной работе над текстом вместо того, чтобы потратить час-другой своего личного времени на объяснение теми же словами, которые изложены в той книге.
Наконец, число «моих» учеников по определению конечно, и невелико, т.е. моя работа малоэффективна. Если пособие окажется полезным, то это повысило бы эффективность моей преподавательской работы.
Я старался написать свои разделы пособия так, чтобы написать о сложных и важных вещах, но, по возможности, понятно для школьников 10-11 класса. Как получилось – судить Вам.
Искренне Ваш,
BR
7. ОДНОАТОМНЫЕ И МНОГОАТОМНЫЕ СПИРТЫ, ФЕНОЛЫ [1]
Спирты – производные углеводородов, в которых один из атомов водорода заменён на гидроксильную группу. Общая формула соединений класса спиртов CnH2n+1OH. Гидроксильная группа является функциональной группой [2], поэтому в брутто-формуле её выделяют отдельно. Многоатомные спирты содержат в составе молекулы более одной гидроксильной группы.
Необходимо помнить следующую особенность: спирты, у которых две гидроксильных группы находятся при одном атоме углерода, как правило, неустойчивы – и подвергаются обратимой дегидратации с образованием карбонильных соединений. Равновесие при этом смещено в сторону образования карбонильного соединения.

Фенолы – производные аренов, в молекулах которых гидроксильная группа связана с ароматическим кольцом. Название «фенол» принадлежит простейшему представителю этого класса – гидроксибензолу.
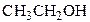
| 
| 
|
| Этанол Этиловый спирт Метилкарбинол | Пропантриол-1,2,3 Глицерин | Фенол Гидроксибензол Карболовая кислота |
К простым эфирам относят соединения общей формулы CnH2n+2O, в молекулах которых атом кислорода связан с двумя углеводородными радикалами. Обычно простые эфиры представляют в виде R-O-R`, где R и R` – алкильные радикалы. Очевидно, что простые эфиры представляют собой межклассовые изомеры спиртов.
Номенклатура и изомерия
Изомерия спиртов включает структурную изомерию углеродного скелета, изомерию положения гидроксильной группы, межклассовую изомерию с простыми эфирами. В ряде случаев для спиртов характерна также оптическая изомерия.
Изомерию многоатомных спиртов и фенолов обычно не обсуждают, однако при необходимости, Вы, конечно, без труда справитесь с подобным заданием.
В основу международной номенклатуры спиртов положены те же принципы, что и при названии углеводородов различных классов. За основу названия выбирается самая длинная углеродная цепь, содержащая гидроксильную группу. Нумерация цепи осуществляется таким образом, чтобы атом углерода, содержащий гидроксильную группу, получил наименьший номер. Все остальные заместители перечисляются в алфавитном порядке с указанием места присоединения к углеродной цепи. В конце названия добавляют суффикс –ол и цифру, указывающую положение гидроксильной группы.
Рациональная номенклатура, как Вы знаете, основана на названии простейшего представителя класса. Особенностью рациональной номенклатуры спиртов является использование названия «карбинол» вместо названия «метиловый спирт».
На примере спиртов Вы также можете познакомиться с тривиальными названиями – теми названиями, которые исторически сложились для отдельных представителей класса. Например, метанол часто называют древесным спиртом или муравьиным спиртом. Первое из этих названий связано с получением метилового спирта при перегонке продуктов пиролиза древесины. Второе, по-видимому, возникло от названия муравьиной кислоты, в составе которой также только один атом углерода.
Названия многоатомных спиртов строятся по тем же принципам, что и названия одноатомных спиртов. При этом в названии появляется приставка, которая указывает на число гидроксильных групп, подобно тому, как производятся названия алкадиенов от названий алкенов. Например: бутандиол-1,2. При этом следует запомнить тривиальные названия этиленгликоль (этандиол-1,2) и глицерин (пропантриол-1,2,3).
Вообще гликолями обычно называют соединения, в структуре которых есть две гидроксильные группы при вицинальных (соседних) атомах углерода. В более общем случае их называют 1,2-гликолями (если атомы углерода с гидроксильными группами разделены другим атомом углерода, такие соединения относят к 1,3-гликолям и т.д.)
При построении названия замещённых фенолов гидроксильная группа, как более старшая, обычно получает номер 1. Относительно неё определяют положения других заместителей. Например: 2-хлорфенол, 3-бромфенол, 2-нитро-5-хлорфенол.
Пример 1. (номенклатура и изомерия спиртов)
| Назовите предложенное соединение по международной номенклатуре. Назовите это вещества по рациональной номенклатуре. На его примере покажите возможные типы изомерии, характерные для спиртов. | 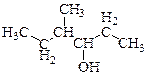
|
Решение.
Самая длинная цепочка, содержащая гидроксильную группу, состоит из шести атомов углерода (углеводород – гексан). Нумерацию осуществляем с того конца, ближе к которому расположена гидроксильная группа (она «старше», чем метильная в положении 4). При этой нумерации атом углерода с гидроксильной группой получает номер 3, а атом углерода с метильной группой – номер 4. Название: 4-метилгексанол-3.
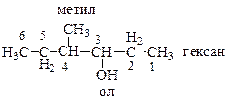

Построение название по рациональной номенклатуре. Выбираем атом углерода, содержащий гидроксильную группу. Этот фрагмент называется карбинол. Какие радикалы присоединены к нему? Перечисляем их. С одной стороны – радикал «этил-», с другой – радикал «втор-бутил». Название: этил втор -бутилкарбинол. Аналогичным образом трет -бутиловый спирт по международной номенклатуре называется 2-метилпропанол-2, а по рациональной – триметилкарбинол.
Изомерия спиртов
Для спиртов, как и для любого класса органических соединений, характерна структурная изомерия по углеродному скелету (изомерия углеродного скелета). При этом изменяется длина и разветвленность углеродной цепи, но главной остается самая длинная из цепочек атомов углерода, содержащая гидроксильную группу.
Гидроксильную группу можно переместить от одного атома углерода к другому без изменения углеродного скелета молекулы. Такой вид изомерии называется структурной по положению функциональной группы (изомерия положения функциональной группы).
Для спиртов характерная межклассовая изомерия с простыми эфирами. При этом вместо гидроксильной группы в составе молекулы появляется атом кислорода, связанный с двумя алкильными радикалами. Для названия простого эфира перечисляют эти радикалы в порядке увеличения сложности, например: диметиловый эфир, метилэтиловый эфир и т.д.
| Структурная изомерия по углеродной цепи | Структурная изомерия по положению функциональной группы | Межклассовая изомерия |
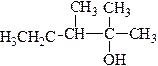
| 
| 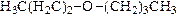
|
| 2,3-диметилпентанол-2 | 3-метилпентанол-3 | н -пропил- н -бутиловый эфир |
Особым видом изомерии, на котором мы до сих пор не заостряли внимания, является оптическая изомерия. Под оптической изомерией понимают такой вид изомерии, когда порядок связывания атомов остается неизменным, но пространственное расположение атомов отличается.
Простейший пример оптической изомерии у Вас всегда перед глазами: это Ваши руки (или ноги): положите одну руку ладонью вниз. На нее положите другую руку также ладонью вниз. При этом напротив большого пальца одной руки располагается мизинец другой, т.е. руки не совмещаются в пространстве. Но при этом одна рука является зеркальным отражением другой.
Если одно вещество является зеркальным отражением другого, такая пара изомеров называется энантиомерами.
В настоящем пособии мы ограничимся только самым простым условием существования оптических изомеров: если в структуре молекулы есть атом углерода, у которого все 4 заместителя различны. Такой атом углерода называют асимметрическим.
Посмотрим на молекулу 1-дейтероэтанола вдоль связи углерод-углерод со стороны гидроксильной группы. При этом мы увидим только ближайший к нам атом углерода, тогда как метильная группа «спрячется» за ним. При этом, как несложно увидеть, возможны два способа расстановки заместителей: по часовой стрелке (OH"D"H) или против часовой. Видно, что проекции во второй строчке являются зеркальным отражением проекций первой строчки, но не совпадают с ними. Таким образом, возникает пара оптических изомеров.
 асимметрический атом
асимметрический атом
| 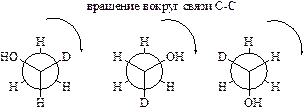
|
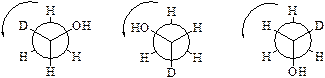
|
В рассматриваемом примере асимметрических атомов углерода целых два: атом углерода под номером 3 (атом водорода, этильный радикал, втор -бутильный радикал, гидроксильная группа) и под номером 4 (атом водорода, метильный радикал, этильный радикал, пропильный радикал, несущий гидроксильную группу). Таким образом, оптическая изомерия возможна: каждый асимметрический атом «ответственен» за возникновение пары оптических изомеров.
Итак, для спиртов характерны: Структурная изомерия по углеродной цепи, Структурная изомерия по положению функциональной группы, Межклассовая изомерия, Оптическая изомерия.
Физические свойства спиртов
Наличие в структуре атома водорода, связанного с электроотрицательным атомом кислорода, позволяет молекулам спиртов образовывать достаточно прочные межмолекулярные водородные связи. Следовательно, благодаря сильному межмолекулярному взаимодействию, температуры плавления и кипения спиртов оказываются гораздо выше, чем у соответствующих углеводородов.
Молекулы многоатомных спиртов, как Вы понимаете, могут образовывать больше межмолекулярных водородных связей за счёт большего числа гидроксильных групп, следовательно, их температуры кипения выше, чем у одноатомных спиртов примерно той же молекулярной массы. При комнатной температуре многоатомные спирты отличаются большей вязкостью.
Фенол представляет собой твёрдое соединение розоватого цвета с неприятным запахом, малорастворимое в воде при комнатной температуре. Невысокая растворимость обусловлена, во-первых, пониженной основностью атома кислорода, во-вторых, наличием гидрофобного ароматического фрагмента. При нагревании происходит сначала образование эмульсии фенола в воде, затем растворение. Фенол растворим в водном растворе щёлочи, что связано с его относительно высокой кислотностью (см. ниже пример 3).
Пример 2. (температуры кипения)
Кратко объясните разницу в физических свойствах следующих изомерных соединений
| Вещество | Т.пл. | Т.кип. |
| Диэтиловый эфир | -116 ºC | +34,6 ºC |
| Бутанол-1 | - 90 ºC | + 117 ºC |
| Бутанол-2 | - 115 ºC | + 98 ºC |
Решение.
Соединения являются изомерами, т.е. имеют одинаковый количественный и качественный состав и одинаковый молекулярный вес, однако их температуры кипения и плавления значительно отличаются. По-видимому, это отличие вызвано их разным строением.
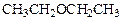
| 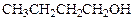
| 
|
| Диэтиловый эфир | Бутанол-1 | Бутанол-2 |
Бутанол-1 и бутанол-2 являются представителями класса спиртов. Молекулы спиртов способны образовывать между собой водородные связи [3], которые обуславливают бóльшие температуры кипения и плавления по сравнению с диэтиловым эфиром, молекулы которого не способны к образованию водородной связи (нет атома водорода, связанного с электроотрицательным элементом). Близкие значения температуры плавления диэтилового эфира и бутанола-2 можно объяснить тем, что в твёрдом состоянии бутанол-2 водородные связи не образует из-за пространственных затруднений, создаваемых метильной и этильной группами. В жидкости за счёт вращения групп становится возможным образование динамической водородной связи. Бутанол-1 образует межмолекулярные водородные связи и в твёрдом, и в жидком состоянии, причём в последнем случае легче, чем бутанол-2 так как пространственные затруднения меньше. Это позволяет в твёрдом состоянии сформировать более компактную кристаллическую решётку, что приводит к большей её прочности, следовательно, более высокой температуре плавления.
Взаимосвязь строения спиртов и их свойств
Кислотные свойства спиртов. Наличие в молекуле спирта электроотрицательного атома кислорода приводит к появлению в молекуле «кислого» атома водорода, связанного с атомом кислорода. Кислород, как более электроотрицательный элемент, перетягивает к себе общую электронную пару ковалентной связи кислород-водород, поэтому под действием сильных оснований возможен отрыв протона с образованием алкоголят-аниона. Таким образом, спирты являются слабыми кислотами (см. пример 3).
Способность к замещению гидроксильной группы. Атом кислорода влияет и на соседний атом углерода. Наличие электроотрицательного атома по соседству приводит к появлению на атоме углерода частичного положительного заряда (δ+). Следовательно, атом углерода может являться центром атаки для различных нуклеофильных реагентов (реакции нуклеофильного замещения).
Спирты как нуклеофильные реагенты. Атом кислорода несёт частичный отрицательный заряд (δ‑), и имеет две неподелённые пары, которые позволяют спиртам выступать в роли нуклеофилов в химических реакциях.
Спирты как основания. Спирт за счет неподеленных пар атома кислорода способен взаимодействовать с протоном (донорно-акцепторный механизм образования ковалентной связи). По определению, молекула или частица, которая предоставляет протону пару электронов, называется основанием Бренстеда, т.е. спирты являются органическими основаниями.
Дегидратация спиртов. Если по соседству с атомом углеродом, несущим гидроксильную группу, находится атом углерода, связанный с атомом водорода, то при определенных условиях (сильная кислота, например, серная или фосфорная, сильное нагревание), возможно отщепление молекулы воды, т.е. дегидратация спирта. Отщепление молекулы воды от спиртов происходит по правилу Зайцева и приводит к образованию алкена (см. настоящее пособие, ч. 1, гл. 3).
Пример 3. (кислотность спиртов)
Расположите в порядке возрастания кислотности в растворе [4] следующие соединения, кратко объясните, почему Вами предложен именно такой ряд кислотности: Этанол, Вода, Фенол, Бутанол-2, Уксусная кислота
Решение.
Кислотность – способность диссоциировать с отщеплением протона.

Кислотность коррелирует с прочностью ковалентной полярной связи кислород-водород. Чем прочнее связь, тем труднее «оторвать» протон, значит, тем слабее кислота (тем меньше кислотность). Следовательно, вопрос задачи сводится к тому, как влияют остальные группы на прочность связи O-H.
В ряду вода, этанол, бутанол-2 возрастает положительный индуктивный эффект алкильных групп, что приводит к увеличению электронной плотности на атоме кислорода, следовательно, к упрочению связи O‑H. Таким образом, в этом ряду кислотность падает.

В молекулах фенола и уксусной кислоты одна из неподелённых пар атома кислорода вступает в сопряжение с π-системой (фенол) или π-связью (уксусная кислота). При этом π‑система выступает «акцептором» – проявляет отрицательный мезомерный эффект[5], что приводит к понижению электронной плотности на атоме кислорода, следовательно, к ослаблению связи O-H. Поэтому фенол[6] и уксусная кислота являются более сильными кислотами, чем вода. Сопряжение с карбонильной группой, в состав которой также входит электроотрицательный атом кислорода, приводит к более сильному смещению электронной плотности, поэтому уксусная кислота по кислотности превосходит фенол.

Ответ: Бутанол-2, Этанол, Вода, Фенол, Уксусная кислота
Многоатомные спирты (этиленгликоль, глицерин) обладают большей кислотностью, чем одноатомные (этанол).
Для объяснения этого явления проведем следующий мысленный эксперимент [7]: сравним кислотность метилового спирта и этиленгликоля. Обратим внимание, что в структуре каждого спирта присутствует фрагмент CH2OH. В молекуле метилового спирта этот фрагмент связан с атомом водорода, электронный эффект которого условно принят за «0». В молекуле этиленгликоля вместо атома водорода присутствует другой фрагмент CH2OH. За счет электроотрицательного атома кислорода этот фрагмент проявляет отрицательный индуктивный эффект (-I), т.е. выступает акцептором электронной плотности. Согласно приведенным выше рассуждениям, данный эффект приводит к уменьшению относительного отрицательного заряда на атоме кислорода этиленгликоля, т.е. к увеличению кислотности этиленгликоля по сравнению с метиловым спиртом.
При отщеплении протона от молекулы 1,2-диола образующийся анион способен к образованию цикла за счёт внутримолекулярной водородной связи. Этот эффект способствует более высокой кислотности.
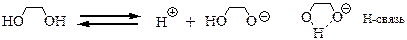
|
|
Дата добавления: 2014-11-07; Просмотров: 2576; Нарушение авторских прав?; Мы поможем в написании вашей работы!