
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции нуклеофильного замещения при насыщенном атоме углерода
|
|
|
|
Взаимодействие спирта с кислотой приводит, к увеличению положительного заряда на атоме углерода, связанном с гидроксильной группой, и к ослаблению этой связи. Возможны 2 сценария развития событий.
Путь А заключается в атаке нуклеофила по атому углерода, связанному с протонированной гидроксильной группой. Нуклеофил атакует атом углерода «с тыла» с вытеснением (выталкиванием) молекулы воды. Процесс проходит синхронно, т.е. одновременно образуется связь нуклеофила с атомом углерода и разрывается связь углерод-кислород. Начальное состояние – протонированная молекула спирта и нуклеофил, конечное состояние – продукт реакции и молекула воды. Это направление процесса характерно для сильных нуклеофилов, которые способны вступать в реакцию даже с малоактивными электрофилами, в данном случае, протонированной молекулой спирта.
В переходном состоянии атом углерода связан с пятью другими атомами, причём образуется многоцентровая связь нуклеофил – атом углерода – уходящая группа. Следовательно, в ходе реакции пространственные напряжения увеличиваются, что приводит к возрастанию энергии переходного состояния. Поэтому путь А реализуется только для первичных и вторичных, но не третичных спиртов – для последних пространственные напряжения чересчур велики.

Важной особенностью данного процесса является стереоспецифичность – в реакции наблюдается образование только одного оптического изомера. Действительно, если для реакции используют оптически чистый спирт (R0, R1, R2 различны), в ходе процесса атом углерода как будто «выворачивается наизнанку», поэтому результатом реакции являются сохранение оптической активности (продукт отклоняет поляризованный свет) и обращение(!) конфигурации при атоме углерода.
|
|
|
Скорость реакции пропорциональна концентрации субстрата и концентрации нуклеофила.
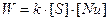 согласно закону действующих масс, порядок реакции равен 2.
согласно закону действующих масс, порядок реакции равен 2.
Данный процесс называется бимолекулярным нуклеофильным замещением при насыщенном атоме углерода и обозначается символом SN2. Термин «бимолекулярный» означает, что на лимитирующей[10] стадии процесса (а в данном случае стадия ровно одна) принимают участие 2 молекулы. Реакция относится к типу замещения («S» от англ. substitution – замещение), активной частицей является нуклеофил («N» от англ. nucleophilic – нуклеофильное).
Механизм SN2 подобен танцу, в котором сильный и уверенный в себе нуклеофил нахально похищает партнершу, разрывая её связь с незадачливой уходящей группой.
Путь Б предполагает медленное превращение протонированной молекулы спирта в карбокатион. Разумеется, эта стадия является эндотермической и требует затраты энергии. Следовательно, именно она является лимитирующей (медленной).
Нетрудно догадаться, что чем устойчивее карбокатион, тем вероятнее его образование. Таким образом, оптимальные условия реализации пути Б создаются для третичного спирта (образуется устойчивый третичный карбокатион), тогда как первичный спирт, напротив, не может превратиться в первичный карбокатион из-за большой затраты энергии. Карбокатион является интермедиатом, т.е. промежуточно образующейся частицей (или продуктом), которую можно зафиксировать специальными методами (например, спектроскопией ядерного магнитного резонанса), т.е. существующей не только у нас в голове, но и на самом деле J.
Очевидно, что образование карбокатиона предполагает понижение гибридизации атома углерода с sp3 до sp2. В результате пространственные напряжения уменьшаются, геометрия карбокатионного фрамента – плоский треугольник с валентным углом около 120° (против 109° в sp3 -гибридном состоянии). Опять же, этот эффект в наибольшей степени проявляется в случае третичного спирта.
|
|
|
Отметим, что положительный заряд локализован на негибридизованной p -орбитали, т.е. на стадии образования карбокатиона происходит потеря оптической активности (появляется плоскость симметрии).
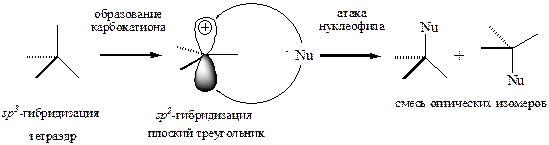
Карбокатион, в отличие от протонированной молекулы спирта, обладает высокой реакционной способностью, что обусловлено наличием положительного заряда на атоме углерода, т.е. большим дефицитом электронной плотности. Поэтому он быстро вступает в дальнейшие превращения. Иными словами, живёт короткой, но насыщенной жизнью. Судьба его может быть такова.
1. Реакция с любым нуклеофилом, присутствующим в реакционной массе. Активность нуклеофила значения не имеет – карбокатион обладает большой энергией, поэтому активность партнёра его мало тревожит.
При этом важное значение имеет концентрация нуклеофила в растворе. Карбокатион будет преимущественно вступать в реакцию с тем нуклеофилом, которого больше. Интуитивно это можно объяснить тем, что карбокатион реагирует с нуклеофилом при встрече. Чаще будут происходить встречи с тем нуклеофилом, концентрация которого больше.
Замечание: скорость реакции от концентрации нуклеофила не зависит! Причина состоит в том, что лимитирующей стадией является образование карбокатиона, за которым следует быстрый перехват карбокатиона нуклеофилом, присутствующим в среде (как только карбокатион получился, то сразу же вступил в реакцию). На ход лимитирующей стадии нуклеофил не оказывает никакого влияния.
Нуклеофил атакует карбокатион равновероятным образом сверху или снизу от плоскости карбокатиона. В результате получается рацемат (смесь равных количеств оптических изомеров), не обладающий оптической активностью.
Этот процесс обозначают как SN1 – мономолекулярное нуклеофильное замещение. Мономолекулярным оно называется потому, что на лимитирующей стадии (образование карбокатиона) принимает участие только 1 молекула. В то же время помните, что этот процесс включает 2 стадии: образование карбокатиона и его реакцию с нуклеофилом.
Механизм SN1 подобен танцу, в котором гордая уходящая группа прерывает долговременные отношения с субстратом и уходит с парой электронов. Очутившийся в жутком электронном дефиците карбокатион ищет поддержку у первого попавшегося нуклеофила.
|
|
|
2. Отщепление протона с образованием алкена. Атом углерода, охваченный сильным дефицитом электронной плотности, отбирает пару электронов у соседней C-H связи (не своей, конечно) – и «выбрасывает» протон «на улицу» совсем без электронов.
3. Карбокатион способен к изомеризации, если в результате образуется более устойчивый карбокатион. Как? Очень просто! Допустим, Вы замерли в каком-то определённом положении. Через некоторое время мышцы устают – и Вы чувствуете потребность переменить его на более удобное (с меньшим напряжением = с меньшей энергией). Карбокатион ведёт себя точно так же. Вновь получившийся карбокатион точно так же может подвергаться превращениям 1-3.
Важно! Карбокатион перегруппировывается только в том случае, если в результате получается более устойчивый карбокатион! Так, из третичного карбокатиона первичный получиться не может – данный процесс энергетически невыгоден. На практике типичным случаем является перегруппировка вторичного карбокатиона в третичный (напомним, что первичный карбокатион, как правило, не образуется, следовательно, и перегруппировываться нечему).
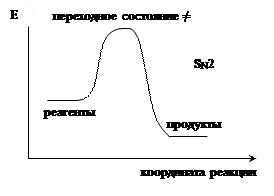
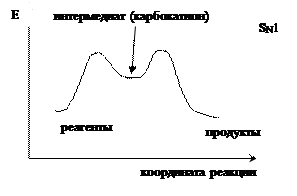
На рисунках приведены энергетические диаграммы, соответствующие бимолекулярному и мономолекулярному нуклеофильному замещению.
| 
|
Переходное состояние – максимум на кривой энергии, отвечающий неустойчивому состоянию системы.
Разность энергий между переходным и начальным состоянием – энергия активации.
Зависимость скорости реакции от величины энергии активации и температуры задаётся уравнением Аррениуса
 , A ≠ f (T), E – энергия активации , A ≠ f (T), E – энергия активации
| Интермедиат – промежуточно образующаяся частица или соединение. На кривой потенциальной энергии интермедиат соответствует локальному минимуму между двумя переходными состояниями. Разность энергий между первым переходным и начальным состояниями больше, чем разность энергий между вторым переходным состоянием и интермедиатом, поэтому лимитирующей является первая стадия, энергия активации которой больше. |
Пример 4. (механизм реакции) ОБЩЕЕ УРАВНЕНИЕ РЕАКЦИИ
|
|
|
Раскройте механизм взаимодействия а) 1-дейтероэтанола с бромоводородной кислотой; б). 1,1,3-тридейтеро-2-метилпропанола-2 с хлороводородом. В реакцию вводят конкретный оптический изомер – оптически активное соединение. Будет ли в результате реакции получаться один продукт (обладающий оптической активностью) или смесь равных количеств двух оптических изомеров (рацемат, не имеющий оптической активности)? Ответ обосновать.

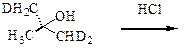
Решение.
а). 1-Дейтероэтанол – первичный спирт, поэтому его взаимодействие с бромоводородной кислотой будет проходить по механизму одностадийного бимолекулярного нуклеофильного замещения (SN2).
Сначала происходит диссоциация бромоводородной кислоты. Поскольку кислота сильная, диссоциацию считаем необратимой, поэтому стрелочка ставится только в одну сторону.
Образовавшийся таким образом протон по донорно-акцепторному механизму принимает на свою вакантную орбиталь неподеленную пару электронов кислорода. Этот процесс обратим. Бромид-ион, как нуклеофил, атакует атом углерода, несущий гидроксильную группу «с тыла», возникает переходное состояние, которое изображают в квадратных скобках. Связи атома углерода с бромом и протонированной гидроксильной группой изображают пунктиром, показывая тем самым, что это не полное, а лишь частичное связывание (одна связь образуется, другая разрывается). Перечеркнутый знак равенства в верхнем правом углу обозначает переходное состояние. Наконец, по окончании реакции получаются продукты: 1-бром-1-дейтероэтан и вода.

В ходе реакции оптическая активность субстрата сохраняется, поэтому продукт реакции будет оптически активным, замещение проходит стереоспецифично с обращением конфигурации асимметрического центра.
б). 1,1,3-Тридейтеро-2-метилпропанол-2 –третичный спирт, атомы дейтерия специально введены в молекулу, чтобы обеспечить оптическую активность. Так как спирт третичный, то его реакция с хлороводородом будет проходить по механизму двухстадийного мономолекулярного нуклеофильного замещения (SN1).
Сначала записываем уравнение диссоциации хлороводорода. Соляная кислота сильная, поэтому будем считать, что она в растворе диссоциирует полностью. Затем, подобно описанному выше, происходит протонирование гидроксильной группы. Алкильные группы надежно блокируют для атаки реакционный центр, поэтому нуклеофил до него добраться не может. Однако, в некоторый момент связь атома углерода и гидроксильной группы самопроизвольно разрывается – и образуется карбокатион и молекула воды. Связь разрывается при колебаниях атомов в молекуле с очень небольшой вероятностью, поэтому процесс идет очень медленно. Карбокатион, по причине острого дефицита электронной плотности, реагирует очень быстро. Если он вступает в реакцию с образовавшейся молекулой воды, то происходит обратный процесс.[11] Если воды в системе мало, гораздо более вероятно взаимодействие карбокатиона с хлорид-ионом, концентрация которого высокая. Таким образом, получается продукт реакции нуклеофильного замещения. Кроме того, в зависимости от условий реакций могут получаться алкены. Доля алкенов возрастает при увеличении температуры реакции. ЗАРЯДЫ, ОБРАТИМОСТЬ!

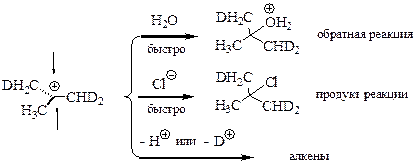
В ходе реакции образуется карбокатион, который не обладает оптической активностью, так как имеет плоскость симметрии. Следовательно, продуктом реакции является рацемат.
Замечание. Как следует из механизма реакции б) вода является нежелательным компонентом смеси, поскольку способствует обратной реакции. Поэтому реакцию проводят так: в чистый спирт пропускают сухой хлороводород (газ), продукт реакции выделяют перегонкой.
В7-1. Вопрос: сколько различных возможных алкенов могут образоваться в данном процессе в качестве побочных продуктов? Перечислите их все и назовите по номенклатуре IUPAC.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 2000; Нарушение авторских прав?; Мы поможем в написании вашей работы!